早教吧作业答案频道 -->化学-->
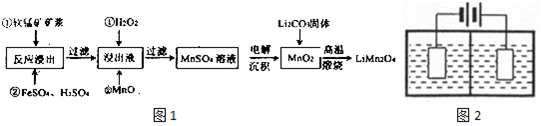
新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2.工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如图1:有关物质的溶度
题目详情
新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2.工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如图1:
有关物质的溶度积常数
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+═Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为___.
(2)流程中,FeSO4的作用是___,MnO的作用是___,当滤液中的pH为6时,滤液中所含铝离子的浓度为___.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为___;电解产生的MnO2沉积在电极上,该电极反应式为___.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为___.
(5)写出高温煅烧生成锰酸锂的化学方程式___.

有关物质的溶度积常数
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(2)流程中,FeSO4的作用是___,MnO的作用是___,当滤液中的pH为6时,滤液中所含铝离子的浓度为___.
(3)采用图2装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为___;电解产生的MnO2沉积在电极上,该电极反应式为___.
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出.则Fe2+与矿浆中MnO2反应的离子方程式为___.
(5)写出高温煅烧生成锰酸锂的化学方程式___.
▼优质解答
答案和解析
(1)锂电池放电正极的电极反应为:LiMn2O4+e-+Li+═Li2Mn2O4,Li2Mn2O4中锰元素+3价,则LiMn2O4中锰元素有+4价,但只有一个锰原子得电子,另一个锰原子未得电子变价,也为+4价,则锂电池正极材料锰酸锂中,锰元素的化合价为+3、+4;
故答案为:+3、+4;
(2)流程中,某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物),FeSO4有还原性,加入FeSO4的作用是与二氧化锰反应,使锰离子进入溶液;
加入MnO调节pH,将铁离子、铝离子沉淀,得到硫酸锰的溶液;
已知的Al(OH)3Ksp为4.5×10-33,当滤液中的pH为6时,则c(OH-)=10-8 mol•L-1滤液中所含铝离子的浓度为
=4.5×10-9 mol•L-1;
故答案为:作还原剂,还原MnO2;调节滤液的pH,除去Fe3+和Al3+;4.5×10-9 mol•L-1;
(3)离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,阴极发生还原反应,阳极发生氧化反应,由流程可知,锰离子生成二氧化锰,反应式为Mn2+-2e-+2H2O=MnO2+4H+,则阳极室为硫酸锰溶液,阴极室为硫酸钠溶液;
故答案为:硫酸钠溶液;Mn2+-2e-+2H2O=MnO2+4H+;
(4)Fe2+与矿浆中MnO2反应的离子方程式为:2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O;
故答案为:2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O;
(5)高温煅烧生成锰酸锂,锰元素化合价降低,则氧元素升价到0价,化学方程式为:8MnO2+2Li2CO3
4LiMn2O4+2CO2↑+O2↑;
故答案为:8MnO2+2Li2CO3
4LiMn2O4+2CO2↑+O2↑.
故答案为:+3、+4;
(2)流程中,某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物),FeSO4有还原性,加入FeSO4的作用是与二氧化锰反应,使锰离子进入溶液;
加入MnO调节pH,将铁离子、铝离子沉淀,得到硫酸锰的溶液;
已知的Al(OH)3Ksp为4.5×10-33,当滤液中的pH为6时,则c(OH-)=10-8 mol•L-1滤液中所含铝离子的浓度为
| 4.5×10-33 |
| (10-8)3 |
故答案为:作还原剂,还原MnO2;调节滤液的pH,除去Fe3+和Al3+;4.5×10-9 mol•L-1;
(3)离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,阴极发生还原反应,阳极发生氧化反应,由流程可知,锰离子生成二氧化锰,反应式为Mn2+-2e-+2H2O=MnO2+4H+,则阳极室为硫酸锰溶液,阴极室为硫酸钠溶液;
故答案为:硫酸钠溶液;Mn2+-2e-+2H2O=MnO2+4H+;
(4)Fe2+与矿浆中MnO2反应的离子方程式为:2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O;
故答案为:2Fe2++MnO2+44H+=2Fe3++Mn2++2H2O;
(5)高温煅烧生成锰酸锂,锰元素化合价降低,则氧元素升价到0价,化学方程式为:8MnO2+2Li2CO3
| ||
故答案为:8MnO2+2Li2CO3
| ||
看了 新型锂电池正极材料锰酸锂(L...的网友还看了以下:
论汽车、飞机、轮船的新材料技术,和同胞们分享海水电解制氢氧化钠、氢气、氯气,间接生产盐酸,用氢氧化 2020-06-19 …
开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是()A.氮化硅陶瓷是新型无机非金属材 2020-07-15 …
开发新材料是现代科技发展的方向之一.下列有关材料的说法正确的是()A.氮化硅陶瓷是新型无机非金属材料 2020-12-17 …
开发新材料是现代科技发展的方向之一.下列有关材料的说法正确的是()A.氮化硅陶瓷是新型无机非金属材料 2020-12-17 …
开发新材料是现代科技发展的方向之一.下列有关材料的说法正确的是()A.氮化硅陶瓷是新型无机非金属材料 2020-12-17 …
发现新材料是现代科技发展的方向之一.下列有关材料的说法正确的是()①硅是构成一些岩石和矿物的基本元素 2020-12-17 …
开发新材料是现代科技发展的方向之一.下列有关材料的说法正确的是A.氮化硅陶瓷是新型无机非金属材料B. 2020-12-17 …
发现新材料是现代科技发展的方向之一。下列有关材料的说法正确的是()①硅是构成一些岩石和矿物的基本元素 2020-12-17 …
开发新材料是现代科技发展的方向之一,下列有关材料的说法正确的是C60属于原子晶体,用于制造纳米材料氮 2020-12-17 …
开发新材料是现代科技发展的方向之一.下列有关材料的说法正确的是()A.氮化硅陶瓷是新型无机非金属材料 2020-12-17 …