早教吧作业答案频道 -->化学-->
铜及其化合物与生产、生活关系密切.(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是(填“氧化剂”或“还原剂”)(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若
题目详情
铜及其化合物与生产、生活关系密切.
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是___(填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,正极的电极反应式为___
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如图1:
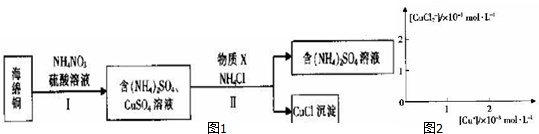
①步骤I中,反应温度不宜过高的原因是___.
②步骤I中,0.5mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为___.
③步骤II中,物质X可选用的物质是___.(填序号).
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是___.
⑤步骤II中当NH4Cl加到一定的量时,生成CuCl会部分溶解生成CuCl2,在一定温度下建立两个平衡:
CuCl(s)⇌Cu+(aq)+Cl-(aq) Ksp=1.4x10-6
CuCl(s)+Cl-(aq)⇌CuCl2(aq) K=0.35
分析[Cu+]、[CuCl2-]和Ksp、K的数学关系,在图1中画出[Cu+]、[CuCl2-]的关系曲线(要求至少标出坐标点)
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是___(填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,正极的电极反应式为___
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如图1:

①步骤I中,反应温度不宜过高的原因是___.
②步骤I中,0.5mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为___.
③步骤II中,物质X可选用的物质是___.(填序号).
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是___.
⑤步骤II中当NH4Cl加到一定的量时,生成CuCl会部分溶解生成CuCl2,在一定温度下建立两个平衡:
CuCl(s)⇌Cu+(aq)+Cl-(aq) Ksp=1.4x10-6
CuCl(s)+Cl-(aq)⇌CuCl2(aq) K=0.35
分析[Cu+]、[CuCl2-]和Ksp、K的数学关系,在图1中画出[Cu+]、[CuCl2-]的关系曲线(要求至少标出坐标点)
▼优质解答
答案和解析
(1)葡萄糖中含有醛基,能够被新制氢氧化铜氧化为羧基,化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2
CH2OH(CHOH)4COOH+Cu2O↓+2H2O,生成葡萄糖酸和Cu2O,Cu元素化合价降低,被还原,为氢氧化铜为氧化剂,葡萄糖为还原剂,被氧化,
故答案为:还原剂;
(2)正极上是元素化合价降低,得到电子发生还原反应,将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,是过氧化氢得到电子发生还原反应,其正极电极反应式是:H2O2+2H++2e-=2H2O,
故答案为:H2O2+2H++2e-=2H2O;
(3)海绵铜加入硫酸酸化的硝酸铵,由于酸性条件下硝酸根离子具有强氧化性,可氧化铜,因硝酸铵易分解,则加热温度不能太高,经步骤Ⅰ得到硫酸铵和硫酸铜溶液,经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,经过滤可得到CuCl和硫酸铵溶液,
①加热温度不能太高,硝酸根离子可被还原生成氮氧化物,易导致环境污染,
故答案为:防止生成氮氧化物造成污染;
②0.5molNH4NO3参加反应有4mol电子转移,则N元素被还原为-3价,反应的离子方程式为4Cu+NO3-+10H+=4Cu2++NH4++3H2O,
故答案为:4Cu+NO3-+10H+=4Cu2++NH4++3H2O;
③经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,ad符合,
故答案为:ad;
④步骤Ⅱ中物质X需要过量,除加快反应速率外,还起到防止CuCl被氧化的作用,
故答案为:防止CuCl被氧化;
⑤已知:Ⅰ.CuCl(s)⇌Cu+(ap)+Cl-(ap) Ksp=1.4×10-6
Ⅱ.CuCl(s)+Cl-(ap)⇌CuCl2- (ap) K=0.35,
Ⅰ+Ⅱ可得2CuCl(s)⇌CuCl2- (ap)+Cu+(ap)K'=[Cu+][CuCl2-=1.4×10-6×0.35=0.49××10-6,即[Cu+][CuCl2-为常数,
则图象为 ,
,
故答案为: .
.
| △ |
故答案为:还原剂;
(2)正极上是元素化合价降低,得到电子发生还原反应,将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,是过氧化氢得到电子发生还原反应,其正极电极反应式是:H2O2+2H++2e-=2H2O,
故答案为:H2O2+2H++2e-=2H2O;
(3)海绵铜加入硫酸酸化的硝酸铵,由于酸性条件下硝酸根离子具有强氧化性,可氧化铜,因硝酸铵易分解,则加热温度不能太高,经步骤Ⅰ得到硫酸铵和硫酸铜溶液,经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,经过滤可得到CuCl和硫酸铵溶液,
①加热温度不能太高,硝酸根离子可被还原生成氮氧化物,易导致环境污染,
故答案为:防止生成氮氧化物造成污染;
②0.5molNH4NO3参加反应有4mol电子转移,则N元素被还原为-3价,反应的离子方程式为4Cu+NO3-+10H+=4Cu2++NH4++3H2O,
故答案为:4Cu+NO3-+10H+=4Cu2++NH4++3H2O;
③经步骤Ⅱ可得到CuCl,反应中Cu元素被还原,则加入的X应具有还原性,可为铜或亚硫酸铵等还原性物质,注意尽量不要引入新杂质,ad符合,
故答案为:ad;
④步骤Ⅱ中物质X需要过量,除加快反应速率外,还起到防止CuCl被氧化的作用,
故答案为:防止CuCl被氧化;
⑤已知:Ⅰ.CuCl(s)⇌Cu+(ap)+Cl-(ap) Ksp=1.4×10-6
Ⅱ.CuCl(s)+Cl-(ap)⇌CuCl2- (ap) K=0.35,
Ⅰ+Ⅱ可得2CuCl(s)⇌CuCl2- (ap)+Cu+(ap)K'=[Cu+][CuCl2-=1.4×10-6×0.35=0.49××10-6,即[Cu+][CuCl2-为常数,
则图象为
 ,
,故答案为:
 .
.
看了 铜及其化合物与生产、生活关系...的网友还看了以下:
反应热计算反应1H1=-1301KJ/MOL反应2H2=-393.5KJ/MOL反应3H3=-285 2020-03-30 …
求几个有机化学反应方程式(注明反应条件、类型)1.C16H34催化剂、加热、加压下的裂化反应2.苯 2020-04-09 …
帮我回答几道初中化学方程式按条件要求写出化学方程式:1.生成黑色固体的化合反应2.生成红色固体的反 2020-05-15 …
高中化学离子方程式问题1.碳酸氢钾与澄清石灰水反应2.亚硫酸钠溶液与稀硫酸反应3.硅与烧碱溶液反应 2020-05-16 …
写出化学方程式和反应类型,1 乙烯和溴的反应 2乙烯和水的反应 3乙烯生成聚乙烯的反应. 谢写出化 2020-05-16 …
[填空]中学化学常见的防热、吸热反应1.常见的放热反应燃烧反应反应金属的氧化铝热反应活泼金属与的反 2020-05-20 …
将气体A、B至于容积为2L的密闭容器中4A+B=2C反应4S末,测得A0.5mol、B0.4mol 2020-07-09 …
写出下列两种反应物相对用量不同时的离子方程式.1、CO2气体与Ca(OH)2(或NaOH)溶液的反 2020-07-26 …
我国高纯氧化镁产品供不应求,工业上可以用硫酸镁还原热解制备,工业流程如下:(1)菱镁矿主要成分是碳酸 2020-12-05 …
改变反应物用量,不能用同一个例子方程式表示的是?1.碳酸氢钠溶液与石灰水反应2.四羟基合铝酸钠溶液与 2021-02-14 …