早教吧作业答案频道 -->化学-->
钨是熔点最高的金属,是重要的战略物资.自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.由黑钨矿冶炼钨的工艺流程如图2:已
题目详情
钨是熔点最高的金属,是重要的战略物资.自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.由黑钨矿冶炼钨的工艺流程如图2:
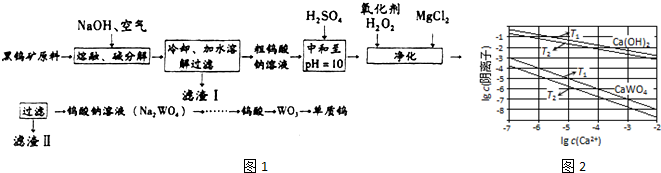
已知:①滤渣I的主要成份是Fe2O3、MnO2.
②上述流程中,只有最后一步钨的化合价改变.
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为___,请写出MnWO4在熔融条件下发生碱分解反应的化学方程式___.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子含有SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___,滤渣II的主要成分是___
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图2为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
①T1___T2(填“>”或“<”);
②T1时Ksp(CaWO4)=___mol•L-1.将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为___,T2时该反应的平衡常数为___mol•L-1.

已知:①滤渣I的主要成份是Fe2O3、MnO2.
②上述流程中,只有最后一步钨的化合价改变.
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为___,请写出MnWO4在熔融条件下发生碱分解反应的化学方程式___.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子含有SiO32-、HAsO32-、HAsO42-、HPO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___,滤渣II的主要成分是___
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.图2为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
①T1___T2(填“>”或“<”);
②T1时Ksp(CaWO4)=___mol•L-1.将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为___,T2时该反应的平衡常数为___mol•L-1.
▼优质解答
答案和解析
(1)钨酸盐FeWO4为钨酸亚铁,钨酸盐(FeWO4、MnWO4)中铁、锰的化合价都为+2价,设钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+x,因化合物中正负化合价代数和为零,则+2+x+(-2)×4=0,解得x=+6,黑钨矿的主要成分是铁和锰的钨酸盐,根据流程图的提示知,黑钨矿在空气中熔融生成WO42-、MnO2,、Fe2O3等,其中转化中生成MnO2的化学反应方程式为2MnWO4+O2+4NaOH
2MnO2+2Na2WO4+2H2O,
故答案为:+6;2MnWO4+O2+4NaOH
2MnO2+2Na2WO4+2H2O;
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,滤液I中存在SiO32-、HAsO32-、HAsO42-、HPO42-等离子,经过调解pH值后,加入氯化镁,Mg2+沉淀SiO32-、HAsO32-、HAsO42-、HPO42-等离子,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4,
故答案为:H2O2+HAsO32-═HAsO42-+H2O;MgSiO3、MgHAsO4、MgHPO4;
(3)①根据图象可知,氢氧化钙和钨酸钙(CaWO4)在钙离子浓度相同时,T1温度下阴离子浓度大于T2,说明T1时的溶度积大于T2,溶度积越大,则溶解度越大,所以T1时溶解度较大,由于“已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小”,则T1<T2,
故答案为:<;
②T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2=CaWO4+2OH-,T2时,c(OH-)=10-2mol/L,c(WO42-)=10-7mol/L,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=
=
=1×103,
故答案为:1×10-10;WO42-+Ca(OH)2=CaWO4+2OH-;1×103.
| ||
故答案为:+6;2MnWO4+O2+4NaOH
| ||
(2)根据以上分析,加入H2O2的目的是将HAsO32-氧化成HAsO42-,离子方程式为H2O2+HAsO32-═HAsO42-+H2O,滤液I中存在SiO32-、HAsO32-、HAsO42-、HPO42-等离子,经过调解pH值后,加入氯化镁,Mg2+沉淀SiO32-、HAsO32-、HAsO42-、HPO42-等离子,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4,
故答案为:H2O2+HAsO32-═HAsO42-+H2O;MgSiO3、MgHAsO4、MgHPO4;
(3)①根据图象可知,氢氧化钙和钨酸钙(CaWO4)在钙离子浓度相同时,T1温度下阴离子浓度大于T2,说明T1时的溶度积大于T2,溶度积越大,则溶解度越大,所以T1时溶解度较大,由于“已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小”,则T1<T2,
故答案为:<;
②T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2=CaWO4+2OH-,T2时,c(OH-)=10-2mol/L,c(WO42-)=10-7mol/L,平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=
| c2(OH-) |
| c(WO42-) |
| (10-2)2 |
| 10-7 |
故答案为:1×10-10;WO42-+Ca(OH)2=CaWO4+2OH-;1×103.
看了 钨是熔点最高的金属,是重要的...的网友还看了以下:
管理学问题:对计划职能的几种错误认识的辨析题1、用在计划上的功夫是一种浪费2、最紧急的工作乃是最需 2020-04-26 …
一游标卡尺的主尺最小分度为1mm,游标上有10个小等分刻度,现用此卡尺来测量工件的直径,如图1所示 2020-05-13 …
一个铁路巡道工正在隧道中工作,突然听到一列火车向隧道驶来.他马上看了一下隧道里的路标.知道他与火车 2020-05-13 …
每个工人连续5天上班,然后连续休息2天,最少需要多少工人?每天最少人数如下:周一17人,周二13人 2020-06-04 …
公路工程里,水稳基层最大干密度比如是2.21,配合比是5:100,那2.21中包括水泥质量吗?比如 2020-07-12 …
工作流水线上顺次排列5个工作台,A,B,C,D,E一只工具箱应该放在何处,才能使工作台上操作机器的人 2020-11-20 …
工程师和工人本质的差别是什么?如题工程师和工人最最最本质的差别是什么? 2020-11-24 …
chuyi如图,工作流程线上放着5个机器人A、B、C、D、E,还放着一只工具箱,5个机器人取工具的次 2020-12-26 …
从2015年11月1日起,宁波市又上调职工最低月工资标准,宁波目前的最低工资标准在全国处于前列。新标 2021-01-16 …
三个工程对共同修筑一条公路,第一个工程队修筑全程的2/5,第二个工程队修筑剩下修筑公路由三个工程队承 2021-01-18 …