早教吧作业答案频道 -->化学-->
实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取CaCl2•2H2O和CaO2的主要流程如下:(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是.试剂X
题目详情
实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取CaCl2•2H2O和CaO2的主要流程如下:
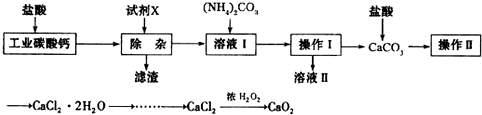
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___.试剂X可以选择下列的___(填编号).
A.CaOB.CaCO3C.NH3•H2OD.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有___.
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是___.
(4)用下列装置测定工业碳酸钙的质量分数
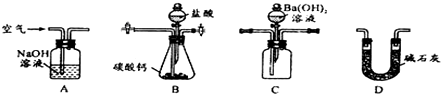
①按A-B-C-D顺序连接,然后从A装置通入空气,目的是___.
②装置D的作用为___.
③实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量百分含量为___.若无D装置,测量结果则___.(填“偏大”、“偏小”、“无影响”)
④上述实验装置中,是否存在不合理之处?___(填“是”或“否”);若有不合理之处,需改进的是___.

(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___.试剂X可以选择下列的___(填编号).
A.CaOB.CaCO3C.NH3•H2OD.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有___.
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是___.
(4)用下列装置测定工业碳酸钙的质量分数

①按A-B-C-D顺序连接,然后从A装置通入空气,目的是___.
②装置D的作用为___.
③实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量百分含量为___.若无D装置,测量结果则___.(填“偏大”、“偏小”、“无影响”)
④上述实验装置中,是否存在不合理之处?___(填“是”或“否”);若有不合理之处,需改进的是___.
▼优质解答
答案和解析
(1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去滤渣的主要成分是氢氧化铝和氢氧化铁,为了保证不引入杂质离子,所以中和盐酸的酸性调节pH值可以用氧化钙或是碳酸钙,而NH3•H2O 和Ba(OH)2会引入杂质;
故答案为:Fe(OH)3、Al(OH)3;AB;
(2)根据蒸发操作所需仪器有玻璃棒、蒸发皿、酒精灯、三脚架,
故答案为:蒸发皿、玻璃棒;
(3)温度过高会导致双氧水分解,引起实验误差,所以由CaCl2制取CaO2的反应中,温度不宜太高;
故答案为:防止温度过高H2O2发生分解;
(4)①根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键,所以从A装置通入空气,目的是保证碳酸钙和盐酸反应产生的二氧化碳全部进入下一个装置,
故答案为:让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性;
②碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰,装置D的作用为防止空气中的CO2与Ba(OH)2溶液反应,
故答案为:防止空气中的CO2与Ba(OH)2溶液反应;
③根据碳酸钙中碳元素守恒,碳酸钙中的碳元素先成为二氧化碳,然后是二氧化碳在和氢氧化钡反应得到碳酸钡沉淀,碳酸钡中的碳元素全部来自碳酸钙中,所以17.73gBaCO3沉淀的物质的量为
=0.09mol,所以碳酸钙的物质的量是0.09mol,质量是9g,百分含量是
×100%=90.00%,若无D装置,空气中的二氧化碳有可能被氢氧化钠吸收,导致BaCO3沉淀的质量偏大,所以计算出的碳酸钙的质量分数偏大,
故答案为:90.00%;偏大;
④根据装置图可知,在B、C装置中分液漏斗中的液体难以顺利流下,所以B、C装置中,为使分液漏斗中的液体顺利流出,用橡皮管将分液漏斗与锥形瓶、分液漏斗与集气瓶连接成连通装置,
故答案为:是;B、C装置中,为使分液漏斗中的液体顺利流出,用橡皮管将分液漏斗与锥形瓶、分液漏斗与集气瓶连接成连通装置.
故答案为:Fe(OH)3、Al(OH)3;AB;
(2)根据蒸发操作所需仪器有玻璃棒、蒸发皿、酒精灯、三脚架,
故答案为:蒸发皿、玻璃棒;
(3)温度过高会导致双氧水分解,引起实验误差,所以由CaCl2制取CaO2的反应中,温度不宜太高;
故答案为:防止温度过高H2O2发生分解;
(4)①根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键,所以从A装置通入空气,目的是保证碳酸钙和盐酸反应产生的二氧化碳全部进入下一个装置,
故答案为:让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性;
②碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰,装置D的作用为防止空气中的CO2与Ba(OH)2溶液反应,
故答案为:防止空气中的CO2与Ba(OH)2溶液反应;
③根据碳酸钙中碳元素守恒,碳酸钙中的碳元素先成为二氧化碳,然后是二氧化碳在和氢氧化钡反应得到碳酸钡沉淀,碳酸钡中的碳元素全部来自碳酸钙中,所以17.73gBaCO3沉淀的物质的量为
| 17.73g |
| 197g/mol |
| 9g |
| 10.00g |
故答案为:90.00%;偏大;
④根据装置图可知,在B、C装置中分液漏斗中的液体难以顺利流下,所以B、C装置中,为使分液漏斗中的液体顺利流出,用橡皮管将分液漏斗与锥形瓶、分液漏斗与集气瓶连接成连通装置,
故答案为:是;B、C装置中,为使分液漏斗中的液体顺利流出,用橡皮管将分液漏斗与锥形瓶、分液漏斗与集气瓶连接成连通装置.
看了 实验室以工业碳酸钙(含少量N...的网友还看了以下:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al2O3的两种工艺品 2020-04-06 …
(1)Na2CO3固体中的NaHCO3,方法是,反应的化学方程式:.(2)除去混入NaCl溶液中少 2020-05-02 …
变质的氢氧化钠可以用()来检验,其化学方程式为();长期露置在空气中的氢氧化钠溶液要除去杂质,可加 2020-05-15 …
长时间放置在空气中的氢氧化钠固体会吸收空气中的而潮解,又会与空气中的起反应,生成杂质,其反应的化学 2020-05-17 …
(1)鉴别KCl溶液和K2CO3的试剂是,离子方程式为.(2)除去混入Fe2O3粉末中少量Al2O 2020-07-16 …
镁及其化合物有广泛用途.工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质) 2020-07-19 …
化学关于粗盐的除杂{急}粗盐中有许多的杂质那么在化学除杂过程中为什么碳酸钠必须在氯化钡之后加入呢?另 2020-11-20 …
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下 2020-12-01 …
防治环境污染,改善生态环境已成为全球的共识.①向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成 2020-12-10 …
久置在空气中的氢氧化钠溶液,会生成一种盐类杂质,向其中加入稀盐酸时会产生无色气体.生成这种杂质的化学 2021-01-18 …