早教吧作业答案频道 -->化学-->
电解质的水溶液中存在电离平衡.(1)醋酸是常见的弱酸.①醋酸在水溶液中的电离方程式为.②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是(填字母序号).A.滴加少
题目详情
电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸.
①醋酸在水溶液中的电离方程式为___.
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是___(填字母序号).
A.滴加少量浓盐酸 B.微热溶液
C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1mol•L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.
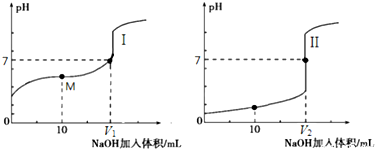
①滴定醋酸的曲线是___(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是___.
③V1和V2的关系:V1___V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___.
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
①写出步骤2中溶液变红色的离子方程式___.
②步骤3中现象a是___.
③用化学平衡原理解释步骤4的实验现象___.
(1)醋酸是常见的弱酸.
①醋酸在水溶液中的电离方程式为___.
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是___(填字母序号).
A.滴加少量浓盐酸 B.微热溶液
C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1mol•L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是___(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是___.
③V1和V2的关系:V1___V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___.
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a ___,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
②步骤3中现象a是___.
③用化学平衡原理解释步骤4的实验现象___.
▼优质解答
答案和解析
(1)①醋酸是一元弱酸,在水溶液中部分电离生成醋酸根离子和氢离子,其电离方程式为CH3COOH⇌CH3COO-+H+,
故答案为:CH3COOH⇌CH3COO-+H+;
②加水稀释、进入和醋酸反应的物质或加热都促进醋酸电离,进入盐酸或醋酸钠都产生同离子效应而抑制醋酸电离,故选BC;
(2)①由图中未加NaOH时的pH可知,图Ⅰ中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为0.1mol/L的盐酸溶液,为醋酸溶液滴定过程,所以滴定醋酸的曲线是I,
故答案为:I;
②0.1mol•L-1 NaOH溶液、0.1mol•L-1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 mol•L-1醋酸溶液,
故答案为:0.1mol•L-1醋酸溶液;
③醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V12,故答案为:<;
④用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO-)>c (Na+)>c (H+)>c (OH-),故答案为:c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)①铁离子遇到硫氰化钾显示红色,发生的反应为:Fe3++3SCN-⇌Fe(SCN)3,故答案为:Fe3++3SCN-⇌Fe(SCN)3;
②加入硝酸银,银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀,故答案为:出现白色沉淀;
③AgSCN(s)⇌Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动,
故答案为:AgSCN(s)⇌Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
故答案为:CH3COOH⇌CH3COO-+H+;
②加水稀释、进入和醋酸反应的物质或加热都促进醋酸电离,进入盐酸或醋酸钠都产生同离子效应而抑制醋酸电离,故选BC;
(2)①由图中未加NaOH时的pH可知,图Ⅰ中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为0.1mol/L的盐酸溶液,为醋酸溶液滴定过程,所以滴定醋酸的曲线是I,
故答案为:I;
②0.1mol•L-1 NaOH溶液、0.1mol•L-1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 mol•L-1醋酸溶液,
故答案为:0.1mol•L-1醋酸溶液;
③醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1
④用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO-)>c (Na+)>c (H+)>c (OH-),故答案为:c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)①铁离子遇到硫氰化钾显示红色,发生的反应为:Fe3++3SCN-⇌Fe(SCN)3,故答案为:Fe3++3SCN-⇌Fe(SCN)3;
②加入硝酸银,银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀,故答案为:出现白色沉淀;
③AgSCN(s)⇌Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI
故答案为:AgSCN(s)⇌Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI
看了 电解质的水溶液中存在电离平衡...的网友还看了以下:
为什么PH低的醋酸导电性会比PH高的盐酸要强书上说因为PH低得醋酸H+离子浓度比盐酸要浓,所以醋酸 2020-04-26 …
梯形的高如何求?S为梯形的面积,为520平方米,A表示梯形的上底,为18米,B表示梯形的下底,为3 2020-05-13 …
温度计上的H 电子温度计,没有说明书,全字母唉H ------- R误差两度,FSW按下IN 说哥 2020-05-16 …
单词填空:1..IIcoulddothat.(横线上的单词开头字母是"w",末尾字母是"h",一共 2020-06-03 …
0.1mol/l的醋酸H+浓度和PH=1的醋酸的差别如果等体积的盐酸和醋酸分别为pH=1,与Zn反 2020-06-05 …
为什么稀释冰醋酸H+、CH3COO-浓度先逐渐增大而后减小 2020-06-07 …
醋的同音字,醋的形近字,醋的换偏旁,醋的去偏旁 2020-06-18 …
"对此可以酣高楼"中倒数第三字读音?hān还是hàn一声?四声? 2020-06-21 …
扞’这个字怎么读扞’这个字到底怎么读啊怎么标准里打"gan'和"han'打不出而全拼里就打"gan 2020-06-29 …
单词填空:1..IIcoulddothat.(横线上的单词开头字母是"w",末尾字母是"h",一共有 2020-11-01 …