已知H2R为二元弱酸:H2R⇌HR-+H+Ka1HR-⇌R2-+H+Ka2常温下,向某浓度的H2R溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2R、HR-、R2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示
已知H2R为二元弱酸:H2R⇌HR-+H+ Ka1 HR-⇌R2-+H+ Ka2
常温下,向某浓度的H2R溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2R、HR-、R2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )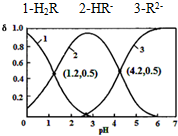
A. pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2R)
B. pH=2.7溶液中:c2(HR-)/[c(H2R)×c(R2-)]=1000
C. 将相同物质的量KHR和K2R固体完全溶于水可配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
B、首先根据图中的1、2交点和2、3交点,结合二元弱酸:H2R⇌HR-+H+,Ka1=
| c(H+)c(HR-) |
| c(H2R) |
| c(H+)•c(R2-) |
| c(HR-) |
| Ka1 |
| Ka2 |
C、pH为4.2的混合液显示酸性,根据图示信息HR-、R2-的物质的量分数相等,各占一半,将相同物质的量KHR和K2R固体完全溶于水,R2-的水解程度较大,所以不可能得到符合条件的混合液,不能这样配得pH为4.2得溶液,故C错误;
D、pH=1.2溶液是KHR溶液,向pH=1.2的溶液中加KOH溶液,KHR溶液和KOH溶液之间会发生反应得到K2R,R2-的水解程度较大,对水的电离起到促进作用,水的电离程度一直增大,故D正确.
故选C.
0.05mol/l盐酸溶液和未知浓度的NaOH溶液以1:2的体积比融合,所得溶液的PH=12.用上 2020-04-27 …
一种pH=3的酸溶液和一种pH=11的碱溶液等体积混合后测得溶液的pH=5.6其原因可能是()A. 2020-05-13 …
相同温度下,电离常数越大的弱酸溶液,溶液的酸性越强 相同温度下,电离常数越大的弱酸溶液,溶液的酸性 2020-05-16 …
::”:“:”:若PH=3的酸溶液和PH=11的碱溶液等体积混合后溶液呈酸性 其原因可能是A 弱酸 2020-05-16 …
求一元弱酸的Ka取0.10mol·L-1某一元弱酸溶液30ml与0.10mol·L-1该酸的钠盐溶 2020-07-19 …
1.在弱酸弱碱溶液中,H+的浓度是指什么,是已经电离出来的还是包括未电离的?同样的在弱酸弱碱溶液中 2020-07-22 …
稀释弱酸溶液怎么判断到底是溶液的体积变化快还是弱酸电离出H+较快稀释弱酸溶液我怎么判断到底是溶液的 2020-07-26 …
维生素C的含量可以在弱酸溶液中用已知溶液的I2溶液进行滴定C6H8O6+I2----C6H6O6+H 2020-10-30 …
下列关于溶液的导电性的说法错误的是()A.强电解质溶液导电能力一定强,弱电解质溶液导电能力一定弱B. 2020-11-17 …
水解常数和电离常数的关系我想知道比如电离平衡常数大水解常数是不是就会小那弱酸或弱碱溶液的酸碱性大小怎 2020-12-23 …