早教吧作业答案频道 -->化学-->
磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3•MgCO3.某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图:请回答下列问题:(1)磷精矿[Ca5(PO4)3F]分解温度(填“
题目详情
磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3•MgCO3.某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图: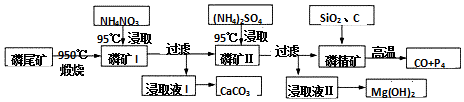
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度___(填“高于”、“低于”)950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是___,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是___.
(3)磷精矿与SiO2、C发生反应时被还原的物质是___.
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示.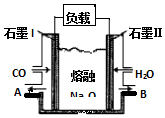
COA石墨I负载BH2O石墨Ⅱ熔融Na2O
写出石墨Ⅰ电极上发生反应的电极反应式___,Na+向___(填写“石墨Ⅰ”或“石墨Ⅱ”)移动.
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸.
①常温下关于1L 0.1mol•L-1 HCOONa溶液,下列关系不正确的是___.
a.c(H+)•c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1L 0.1mol•L-1 HCOONa溶液中加水稀释后,c(HCOOH)•c(OH-)的数值___(填写“增大”“减小”或“不变”).

请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度___(填“高于”、“低于”)950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是___,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是___.
(3)磷精矿与SiO2、C发生反应时被还原的物质是___.
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示.

COA石墨I负载BH2O石墨Ⅱ熔融Na2O
写出石墨Ⅰ电极上发生反应的电极反应式___,Na+向___(填写“石墨Ⅰ”或“石墨Ⅱ”)移动.
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸.
①常温下关于1L 0.1mol•L-1 HCOONa溶液,下列关系不正确的是___.
a.c(H+)•c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1L 0.1mol•L-1 HCOONa溶液中加水稀释后,c(HCOOH)•c(OH-)的数值___(填写“增大”“减小”或“不变”).
▼优质解答
答案和解析
磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C
2CaF2+30CO+18CaSiO3+3P4;
(1)在950℃下煅烧磷尾矿,Ca5(PO4)3F没有分解,可知磷精矿[Ca5(PO4)3F]分解温度高于950℃,故答案为:高于;
(2)NH4NO3溶液中铵离子水解呈酸性,H+能从磷矿I中浸取出Ca2+,CaSO4是微溶于水的盐,则不选用(NH4)2SO4,故答案为:NH4+水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+; CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+;
(3)磷精矿与SiO2、C发生反应时发生的反应为4Ca5(PO4)3F+18SiO2+30C
2CaF2+30CO+18CaSiO3+3P4,反应中P元素的化合价从+5价降为0价,发生还反应,可知被还原的物质是Ca5(PO4)3F,故答案为:Ca5(PO4)3F;
(4)石墨Ⅰ电极是负极,CO发生氧化反应,此反应的电极反应式为CO+O2--2e-=CO2,石墨Ⅱ电极是正极,而原电池工作时Na+向正极移动,故答案为:CO+O2--2e-=CO2;石墨Ⅱ;
(5)①常温下关于1L 0.1mol•L-1 HCOONa溶液中;
a.常温下水的离子积c(H+)•c(OH-)=1×10-14,故a正确;
b. 溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCOO-),物料守恒式为c(Na+)=c(HCOOH)+c(HCOO-),则c(H+)+c(HCOOH)=c(OH-),故b正确;
c.溶液中存在的物料守恒式为c(Na+)=c(HCOOH)+c(HCOO-),故c正确;
d.HCOONa是强碱弱酸盐,其溶液显碱性,c(OH-)>c(H+),故d错误;答案为d;
②向1L 0.1mol•L-1 HCOONa溶液中加水稀释,促进HCOO-的水解,c(HCOO-)减小,c(HCOOH)•c(OH-)=
=Kw×
=Kw×
,则其减小,故答案为:减小.
| ||
(1)在950℃下煅烧磷尾矿,Ca5(PO4)3F没有分解,可知磷精矿[Ca5(PO4)3F]分解温度高于950℃,故答案为:高于;
(2)NH4NO3溶液中铵离子水解呈酸性,H+能从磷矿I中浸取出Ca2+,CaSO4是微溶于水的盐,则不选用(NH4)2SO4,故答案为:NH4+水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+; CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+;
(3)磷精矿与SiO2、C发生反应时发生的反应为4Ca5(PO4)3F+18SiO2+30C
| ||
(4)石墨Ⅰ电极是负极,CO发生氧化反应,此反应的电极反应式为CO+O2--2e-=CO2,石墨Ⅱ电极是正极,而原电池工作时Na+向正极移动,故答案为:CO+O2--2e-=CO2;石墨Ⅱ;
(5)①常温下关于1L 0.1mol•L-1 HCOONa溶液中;
a.常温下水的离子积c(H+)•c(OH-)=1×10-14,故a正确;
b. 溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCOO-),物料守恒式为c(Na+)=c(HCOOH)+c(HCOO-),则c(H+)+c(HCOOH)=c(OH-),故b正确;
c.溶液中存在的物料守恒式为c(Na+)=c(HCOOH)+c(HCOO-),故c正确;
d.HCOONa是强碱弱酸盐,其溶液显碱性,c(OH-)>c(H+),故d错误;答案为d;
②向1L 0.1mol•L-1 HCOONa溶液中加水稀释,促进HCOO-的水解,c(HCOO-)减小,c(HCOOH)•c(OH-)=
| c(HCOOH)•c(OH-)•c(H+) |
| c(H+) |
| c(HCOO-) |
| c(H+) |
| c(HCOO-) |
| Ka(HCOOH) |
看了 磷尾矿难溶于水,主要含Ca5...的网友还看了以下:
9.13提取公因式法(2)的难题比较多的题目 答得好加100分.填空题:4.-mx(m-x)(x- 2020-05-17 …
一蜡块体积为700cm^3,轻放于盛满水的容器中溢出水600cm^3,已知水的密度为1.0*10^ 2020-05-22 …
又难又简单的一道神奇数学题(1)已经3次根号12=b,3次根号0.012=m,3次根号12000, 2020-06-04 …
我觉得很难1.如果m为整数,那么使分式m+3/m+1的值为整数m的值有几个?A.2B.3C.4D. 2020-06-06 …
已知复数z=3+3根号下3i+m(m属于C),且m+3/m-3为纯虚数.(1)求z在复平面内对应点 2020-07-09 …
求经过点A(3,根号3),B(2,3)的椭圆的标准方程列式子会,主要是这个方程组不会解,9/m²+ 2020-07-14 …
求一元二次方程根与系数的关系与判别式定理的难题集锦解法.(卷子内容问题补充)1、是否存在实数m,使 2020-08-01 …
主要关于水的浮力的!静止在空中的充满氢气的飞艇,体积为3*10^5的m^3,已知空气的密度为1.29 2020-12-23 …
TeddySmith’sFastFoodOpen:10:00a.m.---10:30p.m.Lunc 2021-01-08 …
TeddySmith’sFastFoodOpen:10:00a.m.---10:30p.m.Lunc 2021-01-08 …