早教吧作业答案频道 -->化学-->
氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.(1)以铁为催化剂,0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质
题目详情
氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.
(1)以铁为催化剂,0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1.
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线.
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是___(填增大、减少或不变).
(2)①N2H4是一种2高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式___.
②N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液的pH等于___(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4,则N2H4(l)的标准燃烧热△H=___
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸. 实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释.

(1)以铁为催化剂,0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1.
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线.
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是___(填增大、减少或不变).
(2)①N2H4是一种2高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式___.
②N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液的pH等于___(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4,则N2H4(l)的标准燃烧热△H=___
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸. 实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释.
▼优质解答
答案和解析
(1)①0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.3 0.9 0.6
平衡(mol):0.3 0.9 0.6
在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,则此时c(H2)=
=0.45mol/L;
体系达到平衡时N2的总转化率为38.2%,则转化的氮气为0.6mol×38.2%=0.2292mol;
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.23 0.69 0.46
平衡(mol):0.37 1.11 0.46
所以第二次平衡时c(H2)=
=0.555mol/L,
则第25min起H2的物质的量浓度为0.45mol/L,平衡时为0.555mol/L,所以图象为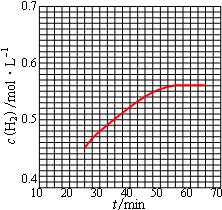 ;
;
故答案为: ;
;
②催化剂能增大反应速率,所以该反应体系未达到平衡时,催化剂对逆反应速率的影响是增大;
故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O⇌N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=
=
=1.0×10-6,所以c(OH-)=10-4mol/L,则c(H+)=10-10mol/L,则溶液的pH=10;
故答案为:10;
③已知:N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4
由盖斯定律可知,N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=
△H2-△H1-
△H4;
故答案为:
△H2-△H1-
△H4;
(3)由NO2转化为HNO3的工艺图可知,N2O4与水、氧气反应生成硝酸,2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,当高于5.11,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:2N2O4+2H2O+O2=4HNO3,中N2O4/H2O的质量比等于5.11,高于5.11是为了提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
最后一问少了流程图,请填上谢谢,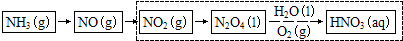
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.3 0.9 0.6
平衡(mol):0.3 0.9 0.6
在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,则此时c(H2)=
| 0.9mol |
| 2L |
体系达到平衡时N2的总转化率为38.2%,则转化的氮气为0.6mol×38.2%=0.2292mol;
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.23 0.69 0.46
平衡(mol):0.37 1.11 0.46
所以第二次平衡时c(H2)=
| 1.11mol |
| 2L |
则第25min起H2的物质的量浓度为0.45mol/L,平衡时为0.555mol/L,所以图象为
 ;
;故答案为:
 ;
;②催化剂能增大反应速率,所以该反应体系未达到平衡时,催化剂对逆反应速率的影响是增大;
故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O⇌N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=
| c(N2H5+)×c(OH-) |
| c(N2H4) |
| c2(OH-) |
| 0.01 |
故答案为:10;
③已知:N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4
由盖斯定律可知,N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:
| 3 |
| 2 |
| 1 |
| 2 |
(3)由NO2转化为HNO3的工艺图可知,N2O4与水、氧气反应生成硝酸,2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,当高于5.11,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:2N2O4+2H2O+O2=4HNO3,中N2O4/H2O的质量比等于5.11,高于5.11是为了提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
最后一问少了流程图,请填上谢谢,
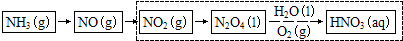
看了 氨气及其相关产品是基本化工原...的网友还看了以下:
北方的冬天,在暖和的室内玻璃上会“出汗”或“结冰花”,下列说法正确的是()A.“汗”出在玻�北方的 2020-04-07 …
求解答数学题!谢谢了!验收某批货物时,规定在到货的1000件样品中次品不多于10时方能接受,如果整 2020-04-27 …
点P为二面角内一点,P到α和β的距离分别为PM=2√2,PN=4,且P到AB的距离为PT=4√2, 2020-05-13 …
真核生物的细胞分裂从间期进入前期除了核膜核仁消失在显微镜下还可观察到什么的出现还可观察到 和 的出 2020-05-17 …
用沿水平向左、大小为15N的拉力拉一个重50N的物体在水平面以2m/s的速度做匀速直线运动,物体除 2020-05-17 …
宰相大臣由座到站在到跪的上朝礼仪变化,反映怎样的历史发展趋势 2020-05-17 …
萝卜在暖和的地方放不了几天就会空心,如果放在冰箱里,就能多放一段时间,这是为什么? 2020-05-22 …
采用塑料薄膜养护混凝土适用在()℃到40℃的气温范围内使用。A.-14B.-12C.-10D.-8 2020-05-27 …
()进行室外拍摄时,是不可能得到软光光效的。A.在柔和的阳光下B.在没有直射光的宽敞阴影区C.选择阴 2020-05-31 …
廉颇蔺相如由不和到和的根本原因是什么? 2020-06-05 …