早教吧作业答案频道 -->化学-->
2015年9月爆发的德国大众车尾气排放作弊事件引起了公众的关注.大众车尾气中常含有大里氮氧化物.通常会采用喷射尿素溶液的方法,将有毒的氮氧化物还原成无污染的物质.大众选择了
题目详情
2015年9月爆发的德国大众车尾气排放作弊事件引起了公众的关注.大众车尾气中常含有大里氮氧化物.通常会采用喷射尿素溶液的方法,将有毒的氮氧化物还原成无污染的物质.大众选择了一种违规做法,即在客户平时用车时不开启喷射尿素的尾气后处理系统,而是通过软件让这一系统只在尾气排放检测时启动.
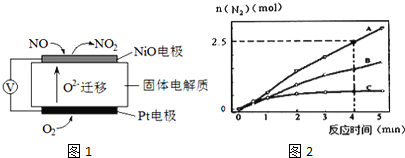
Ⅰ、通过NOx传感器可监测空气的NOx的含量,其工作原理图如图,写出NiO电极的电极反应式___;
Ⅱ、以CO2与NH3为原料可合成尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
(1)写出CO2与NH3合成尿素和液态水的热化学反应方程式___;
(2)恒温下将2molNH3和1molCO2放入容积为2L的密闭容器中,反应生成NH2CO2NH4(s),2分钟后达到平衡.此时NH3的浓度为0.8mol/L,则CO2的反应速率为___,NH3的转化率是___.
Ⅲ、尿素在一定温度下可分解生成NH3,NH3催化还原NxOy可以消除氮氧化物的污染.已知:
反应a:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)
反应b:2NO(g)+O2(g)═2NO2(g)
反应c:4NH3(g)+6NO2(g)═5N2(g)+3O2(g)+6H2O(l)
(1)相同条件下,反应a在2L密闭容器内,选用不同的催化剂,反应产物N2的量随时间变化如图2所示.下列说法正确的是___.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)对于反应c来说,可加快反应速率的措施有___(任写2种)
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,在其他条件不变时,再充入NO2气体,NO2体积分数___(填“变大”、“变小”或“不变”).

Ⅰ、通过NOx传感器可监测空气的NOx的含量,其工作原理图如图,写出NiO电极的电极反应式___;
Ⅱ、以CO2与NH3为原料可合成尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
(1)写出CO2与NH3合成尿素和液态水的热化学反应方程式___;
(2)恒温下将2molNH3和1molCO2放入容积为2L的密闭容器中,反应生成NH2CO2NH4(s),2分钟后达到平衡.此时NH3的浓度为0.8mol/L,则CO2的反应速率为___,NH3的转化率是___.
Ⅲ、尿素在一定温度下可分解生成NH3,NH3催化还原NxOy可以消除氮氧化物的污染.已知:
反应a:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)
反应b:2NO(g)+O2(g)═2NO2(g)
反应c:4NH3(g)+6NO2(g)═5N2(g)+3O2(g)+6H2O(l)
(1)相同条件下,反应a在2L密闭容器内,选用不同的催化剂,反应产物N2的量随时间变化如图2所示.下列说法正确的是___.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)对于反应c来说,可加快反应速率的措施有___(任写2种)
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,在其他条件不变时,再充入NO2气体,NO2体积分数___(填“变大”、“变小”或“不变”).
▼优质解答
答案和解析
I、NiO电极上NO失电子和氧离子反应生成二氧化氮,NiO为负极,所以电极反应式为:NO+O2--2e-=NO2,
故答案为:NO+O2--2e-=NO2;
Ⅱ、(1):①2NH3(g)+CO2(g)→NH2CO2 NH4(s)+l59.5kJ•mol-1
②NH2CO2NH4(s)→CO(NH2)2(s)+H2O(g)-116.5kJ•mol-1
③H2O(l)→H2O(g)-44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
(2)2NH3+CO2⇌NH2CO2NH4,
起始量(mol/L) 1 0.5 0
变化量(mol/L)0.2 0.1 0.1
平衡量(mol/L) 0.8 0.4 0.1
CO2的反应速率v(CO2)=
=0.05mol/(L•min)
NH3的转化率=
×100%=
×100%=20%,
故答案为:0.05mol/(L•min);20%;
III、(1)A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(2)化学反应温度高,增加NH3或NO2或N2或O2的浓度;增大压强等;反应速率快,
故答案为:增加NH3或NO2或N2或O2的浓度、升高温度、增大压强等;
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,再充入NO2气体,虽然平衡逆向移动,但NO2体积分数还是变大,
故答案为:变大.
故答案为:NO+O2--2e-=NO2;
Ⅱ、(1):①2NH3(g)+CO2(g)→NH2CO2 NH4(s)+l59.5kJ•mol-1
②NH2CO2NH4(s)→CO(NH2)2(s)+H2O(g)-116.5kJ•mol-1
③H2O(l)→H2O(g)-44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
(2)2NH3+CO2⇌NH2CO2NH4,
起始量(mol/L) 1 0.5 0
变化量(mol/L)0.2 0.1 0.1
平衡量(mol/L) 0.8 0.4 0.1
CO2的反应速率v(CO2)=
| 0.1mol/L |
| 2min |
NH3的转化率=
| 消耗量 |
| 起始量 |
| 0.1mol |
| 0.5mol |
故答案为:0.05mol/(L•min);20%;
III、(1)A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(2)化学反应温度高,增加NH3或NO2或N2或O2的浓度;增大压强等;反应速率快,
故答案为:增加NH3或NO2或N2或O2的浓度、升高温度、增大压强等;
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,再充入NO2气体,虽然平衡逆向移动,但NO2体积分数还是变大,
故答案为:变大.
看了 2015年9月爆发的德国大众...的网友还看了以下:
13.太空授课中,王亚平成功地制成了晶莹剔透的大水球,并用注射器在水球中注入了红色的液体,最终看到 2020-05-17 …
1.为了用注射器抽吸密封在药瓶中的药液,医生先向药液里注入一些空气,这样做的目的是-------- 2020-06-20 …
下面这道题运用了什么运算定律?例如:50×79×20=(50×20)×79下面这道题运用了什么运算 2020-07-17 …
乘法和减法结合律能不能用什么简便方式算下题!最后能把运算过程和用这个方法的道理告诉我!(x-5)× 2020-07-31 …
如图,用注射器吸进一些乙醚,然后用橡皮塞堵住注射口,先向外拉动活塞,则会发现液态乙醚成蒸气而看不见了 2020-11-05 …
(2014•顺德区模拟)太空授课中,王亚平成功地制成了晶莹剔透的大水球,并用注射器在水球中注入了红色 2020-11-28 …
用注射器吸入一些乙醚,用橡皮塞堵住注射孔.先向外拉动活塞,当针筒中的乙醚液体消失时,再推压活塞.观察 2020-11-29 …
为了用注射器抽吸密封在药瓶中的药液,医生先向药液中注入一些空气,这样做的目的是. 2020-12-24 …
有一种饮料的标签上注有“低热量可乐”,还注明了“100ml只有1.7KJ”.一瓶这种饮料为375ml 2020-12-26 …
量筒的注意事项和使用方法要分开,使用方法为使用方法,注意事项为注意事项.用①②③这样的规格. 2021-01-01 …