请仔细观察两种电池的构造示意图,回答下列问题:(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:。(2
请仔细观察两种电池的构造示意图,
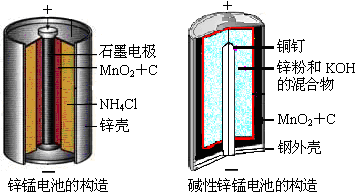
回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,
则负极的电极反应式: 。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其可能的原因是 。
(3)原电池可将化学能转化为电能。某课外活动小组设计两种类型的原电池,以 探究其能量转化效率。
限选材料:ZnSO4(aq), CuSO4(aq);铜片,锌片和导线。
①完成原电池甲的装置示意图(见下图),并作相应标注。
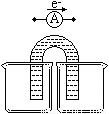
(要求:在同一烧杯中,电极与溶液含相同的金属元素)
②组装原电池乙,要求:以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,(填“甲”或“乙”),其原因是 。
(1)Zn+2OH--2e-=Zn(OH) 2(2)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大。(3)①
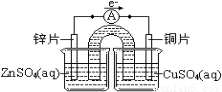
②金属被腐蚀(氧化),表面有红色固体物质生成。
③甲 有盐桥存在时,负极金属与CuSO4(aq)没有直接接触,二者不会发生置换反应,化学能不会转化成热能,几乎全部转化成电能。
分 析:
(1)电池是碱性电池,负极是化合价升高,发生氧化反应,因此Zn作负极,先写出Zn-2e-=Zn(OH)2,再根据反应前后原子个数守恒,配平其他,负极电极反应式:Zn+2OH--2e-=Zn(OH)2;(2)从影响反应速率的因素分析,分析两个电池的结构,锌锰电池负极是锌片,而碱性锌锰电池负极是锌粉,锌粉增加了反应物的接触面积,加快了反应速率,使放电电流大幅度提高;(3)①根据题目所给的装置图,得知:左边烧杯是负极,材料是Zn,右边烧杯是正极才,材料是铜片,左烧杯的盛放的溶液是ZnSO4(aq),右边烧杯是CuSO4(aq),因此装置图为: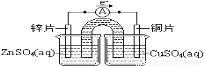 ;
;
②根据原电池的工作原理:锌作负极,Zn-2e-=Zn2+,质量减少,一段时间后锌表面有红色物质生成;③两种原电池原电池甲放电时间较长,因此甲装置更能有效地将化学能转化为电能;有盐桥存在时,负极金属与CuSO4(aq)没有直接接触,二者不会发生置换反应,化学能不会转化成热能,几乎全部转化成电能。
考点:
考查原电池的工作原理。
(2013•河南模拟)已知:NH3•H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H= 2020-04-08 …
一元酸、二元酸是根据分子中能电离的H原子个数划分的还是根据酸分子中有的H原子个数划分的?为什么? 2020-05-19 …
水电里出的H+和OH-不是很少吗?物质在水中与H+或OH-发生水解生成物不会更少吗物质与水电离的H 2020-05-24 …
可逆反应热化学方程式的△H是指什么? 2020-06-05 …
常温下0.1mol/L的盐酸溶液的pH值是多少?是不是1?但是盐酸溶液中的水不也要电离吗?水电离的 2020-06-07 …
今天刚接触了水的电离,有这么一个问题,常温下,0.1MOL/L盐酸水溶液电离,求C(OH-)解的过 2020-06-10 …
为什么加H+或OH-后,水电离的H+和OH-始终相等.H2OH++OH-,加H+后,不会反应一点O 2020-07-08 …
已知:MOH为一元弱碱,2MOH(aq)+H2SO4(aq)=M2SO4(aq)+2H2O(l)△ 2020-07-17 …
某水溶液中由水电离的H+离子浓度c(H+)=10-13mol/L,则该溶液的pH可能是()A.1B 2020-07-26 …
设NA为阿伏伽德罗常数的值.下列说法正确的是()A.室温下,1LpH=1的盐酸中,由水电离的H+离子 2020-11-17 …