早教吧作业答案频道 -->化学-->
X、Y、Z、W均为含有10电子的微粒,W为离子,X、Y、Z为分子,且X与Z分子中含有的共用电子数之比为3:4.(1)X的电子式;若实验室用如图所示装置制取X,则制取X的化学反应方程
题目详情
X、Y、Z、W均为含有10电子的微粒,W为离子,X、Y、Z为分子,且X与Z分子中含有的共用电子数之比为3:4.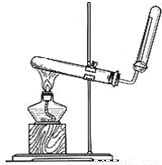
(1)X的电子式______;若实验室用如图所示装置制取X,则制取X的化学反应方程式为______ CaCl 2 +2NH 3 ↑+2H 2 O

(1)X的电子式______;若实验室用如图所示装置制取X,则制取X的化学反应方程式为______ CaCl 2 +2NH 3 ↑+2H 2 O
▼优质解答
答案和解析
分析:
(1)10个电子的微粒有:分子:CH4、NH3、H2O、HF、Ne;阴离子:N3-、O2-、F-、OH-、NH2-; 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+,根据X与Z分子中含有的共用电子数之比为3:4,即可确定X为NH3,含有3对共用电子对;Z为CH4,含有4对共用电子对,实验室制取氨气的原理为:氨盐+碱氨气,氨盐通常用NH4Cl,碱通常用Ca(OH)2;(2)根据W+X+H2O→白色沉淀,W为离子,X为NH3,溶于水即得氨水,能与氨水反应生成白色沉淀的离子W可能为Mg2+、Al3+,为进一步确定W,只需取上述白色沉淀少量置于试管中,加氢氧化钠溶液,观察是否溶解;(3)根据Y为分子,且常温下取10ml pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化而增大,稀释至1000ml时PH<a+2,则Y的水溶液为弱酸,即为氢氟酸,Y化学式为HF.(4)根据H2的燃烧方程式和CH4的燃烧方程式,结合已知条件计算求解.
(1)10个电子的微粒有:分子:CH4、NH3、H2O、HF、Ne;阴离子:N3-、O2-、F-、OH-、NH2-; 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+.根据X与Z分子中含有的共用电子数之比为3:4,即可确定X为NH3,含有3对共用电子对;Z为CH4,含有4对共用电子对.实验室制取氨气的原理为:氨盐+碱氨气,氨盐通常用NH4Cl,碱通常用Ca(OH)2.则X的电子式:,实验室制取氨气的方程式为:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O.故答案为:;Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O;(2)根据W+X+H2O→白色沉淀,W为离子,X为NH3,溶于水即得氨水,能与氨水反应生成白色沉淀的离子W可能为Mg2+、Al3+,生成的白色沉淀可能为Mg(OH)2、Al(OH)3,Mg(OH)2白色沉淀不与NaOH反应,Al(OH)3白色沉淀与NaOH反应,方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,使白色沉淀消失.所以为进一步确定W离子,只需取上述白色沉淀少量置于试管中,加氢氧化钠溶液,观察是否溶解,若能溶解则W是Al3+,若不能溶解则W是Mg2+.故答案为:加入氢氧化钠溶液(或足量氢氧化钠溶液),若观察到白色沉淀溶解(或白色沉淀全部溶解),则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+;(3)根据Y为分子,且常温下取10ml pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化而增大,稀释至1000ml时PH<a+2,则Y的水溶液为弱酸,即为氢氟酸,Y化学式为HF.下列叙述中①Y溶于水部分电离,由于氢氟酸为弱酸,是弱电解质,所以电离程度为部分电离.故①正确;②稀释后所有离子的浓度均减小,由于溶液体积增大,c(H+)、c(F-)都减小,而溶液中c(H+)?c(OH-)═10-14是一个恒定的值,C(H+)减小,则C(OH-)增大,故②错误;③Y的水溶液通常保存在玻璃瓶中,由于氢氟酸能与玻璃反应,方程式为:SiO2+4HF═SiF4+2H2O,所以不能保存在玻璃瓶中,故③错误;④稀释后,阴离子的物质的量浓度之和增大,根据溶液中电荷守恒:C(H+)═C(F-)+C(OH-),而C(H+)减小,所以阴离子的物质的量浓度之和也减小,故④错误.故答案为:HF;①;(4)已知H2的燃烧热为285.8kJ/mol.其热化学方程式为:H2(g)+O2(g)H2O(l);△H═-285.8kJ/mol.Z为CH4,其燃烧化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)设混合气体中H2的物质的量为x,CH4的物质的量为y,1molH2转移电子的物质的量为2mol,CH4中碳为-4价,CO2中碳为+4价,则1molCH4转移电子的物质的量为8mol,H2(g)+O2(g)H2O(l);△H═-285.8kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(1)则:解得:即0.1molH2放出的热量为28.58kJ,0.1molCH4放出的热量为117.6kJ-28.58kJ,为89.02 kJ,则1molCH4放出的热量为890.2 kJ,故热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.2 kJ/mol.CH4中碳元素化合价为-4价,燃烧转变为CO2中碳为+4价,失去8e-,同时在KOH溶液中反应转变为CO32-和H2O,结合电荷守恒配平可得电极反应式:CH4-8e-+10 OH-=CO32-+7H2O,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.2 kJ/mol;CH4-8e-+10OH-=CO32-+7H2O.
点评:
本题考查10电子微粒、氨气的实验室制法、Mg2+和Al3+的检验、弱酸的电离、离子守恒、热化学方程式的计算等内容,难度中等,解题时需抓住10电子微粒进行推断,结合相关知识,尤其是弱酸的电离和离子的电荷守恒,综合运用进行解题.
分析:
(1)10个电子的微粒有:分子:CH4、NH3、H2O、HF、Ne;阴离子:N3-、O2-、F-、OH-、NH2-; 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+,根据X与Z分子中含有的共用电子数之比为3:4,即可确定X为NH3,含有3对共用电子对;Z为CH4,含有4对共用电子对,实验室制取氨气的原理为:氨盐+碱氨气,氨盐通常用NH4Cl,碱通常用Ca(OH)2;(2)根据W+X+H2O→白色沉淀,W为离子,X为NH3,溶于水即得氨水,能与氨水反应生成白色沉淀的离子W可能为Mg2+、Al3+,为进一步确定W,只需取上述白色沉淀少量置于试管中,加氢氧化钠溶液,观察是否溶解;(3)根据Y为分子,且常温下取10ml pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化而增大,稀释至1000ml时PH<a+2,则Y的水溶液为弱酸,即为氢氟酸,Y化学式为HF.(4)根据H2的燃烧方程式和CH4的燃烧方程式,结合已知条件计算求解.
(1)10个电子的微粒有:分子:CH4、NH3、H2O、HF、Ne;阴离子:N3-、O2-、F-、OH-、NH2-; 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+.根据X与Z分子中含有的共用电子数之比为3:4,即可确定X为NH3,含有3对共用电子对;Z为CH4,含有4对共用电子对.实验室制取氨气的原理为:氨盐+碱氨气,氨盐通常用NH4Cl,碱通常用Ca(OH)2.则X的电子式:,实验室制取氨气的方程式为:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O.故答案为:;Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O;(2)根据W+X+H2O→白色沉淀,W为离子,X为NH3,溶于水即得氨水,能与氨水反应生成白色沉淀的离子W可能为Mg2+、Al3+,生成的白色沉淀可能为Mg(OH)2、Al(OH)3,Mg(OH)2白色沉淀不与NaOH反应,Al(OH)3白色沉淀与NaOH反应,方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,使白色沉淀消失.所以为进一步确定W离子,只需取上述白色沉淀少量置于试管中,加氢氧化钠溶液,观察是否溶解,若能溶解则W是Al3+,若不能溶解则W是Mg2+.故答案为:加入氢氧化钠溶液(或足量氢氧化钠溶液),若观察到白色沉淀溶解(或白色沉淀全部溶解),则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+;(3)根据Y为分子,且常温下取10ml pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化而增大,稀释至1000ml时PH<a+2,则Y的水溶液为弱酸,即为氢氟酸,Y化学式为HF.下列叙述中①Y溶于水部分电离,由于氢氟酸为弱酸,是弱电解质,所以电离程度为部分电离.故①正确;②稀释后所有离子的浓度均减小,由于溶液体积增大,c(H+)、c(F-)都减小,而溶液中c(H+)?c(OH-)═10-14是一个恒定的值,C(H+)减小,则C(OH-)增大,故②错误;③Y的水溶液通常保存在玻璃瓶中,由于氢氟酸能与玻璃反应,方程式为:SiO2+4HF═SiF4+2H2O,所以不能保存在玻璃瓶中,故③错误;④稀释后,阴离子的物质的量浓度之和增大,根据溶液中电荷守恒:C(H+)═C(F-)+C(OH-),而C(H+)减小,所以阴离子的物质的量浓度之和也减小,故④错误.故答案为:HF;①;(4)已知H2的燃烧热为285.8kJ/mol.其热化学方程式为:H2(g)+O2(g)H2O(l);△H═-285.8kJ/mol.Z为CH4,其燃烧化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)设混合气体中H2的物质的量为x,CH4的物质的量为y,1molH2转移电子的物质的量为2mol,CH4中碳为-4价,CO2中碳为+4价,则1molCH4转移电子的物质的量为8mol,H2(g)+O2(g)H2O(l);△H═-285.8kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(1)则:解得:即0.1molH2放出的热量为28.58kJ,0.1molCH4放出的热量为117.6kJ-28.58kJ,为89.02 kJ,则1molCH4放出的热量为890.2 kJ,故热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.2 kJ/mol.CH4中碳元素化合价为-4价,燃烧转变为CO2中碳为+4价,失去8e-,同时在KOH溶液中反应转变为CO32-和H2O,结合电荷守恒配平可得电极反应式:CH4-8e-+10 OH-=CO32-+7H2O,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.2 kJ/mol;CH4-8e-+10OH-=CO32-+7H2O.
点评:
本题考查10电子微粒、氨气的实验室制法、Mg2+和Al3+的检验、弱酸的电离、离子守恒、热化学方程式的计算等内容,难度中等,解题时需抓住10电子微粒进行推断,结合相关知识,尤其是弱酸的电离和离子的电荷守恒,综合运用进行解题.
看了 X、Y、Z、W均为含有10电...的网友还看了以下:
一道比例线段若三分之X=四分之Y=五分之Z则Y分之(X-Y+Z):X分之(Y+Z-X)=? 2020-03-30 …
已知a分之一减a的绝对值等于1,则a分之一加a的绝对值为?已知a分之一减绝对值a等于1,则a分之一 2020-04-05 …
若a分之一减b分之一=a+b分之一,则a分之b减b分之a-3的值是 2020-04-06 …
分数除法练习①十二分之七除以九表示()②a为自然数,则五分之一除以a=()乘以()=();a分之一 2020-04-27 …
如果ab+3=12,则9/a=b/1对吗为什么?如果ab+3=12,则九分之a=b分之1 2020-05-13 …
找规律填数,数列三分之一,二分之一,九分之五,十二分之七,五分三,十八分之十一,是按某种规律排列的 2020-05-13 …
从算是二分之一加四分之一加六分之一加八分之一加就十分之一加十二分之一中,必须去掉两个分数,才能使剩 2020-05-14 …
若b分之a=n分之m,则bc分之ac=n分之m,(c不等于0这句话对不对 2020-05-16 …
若a与b互为倒数,则2分之a×5分之b=(),4分之a÷b分之5=() 2020-05-16 …
已知sin(六分之π+α)=三分之一,则(三分之π-α)的值为?A(二分之一)B(-二分之一)C( 2020-06-03 …