早教吧作业答案频道 -->化学-->
已知常温下,H2SO3的电离常数Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3的电离常数Ka1=4.30×10-7,Ka2=5.60×10-11.(1)下列微粒可以大量共存的是(填选项字母).A.CO32-、HSO3-B.HCO3-、HSO
题目详情
已知常温下,H2SO3的电离常数Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3的电离常数Ka1=4.30×10-7,Ka2=5.60×10-11.
(1)下列微粒可以大量共存的是___(填选项字母).
A.CO32-、HSO3-B. HCO3-、HSO3-C. SO32-、HCO3-D. H2SO3、HCO3-
(2)已知NaHSO3溶液显酸性,NaHSO3溶液中离子浓度关系不正确的是___(填序号).
A.c(Na+)=2c(SO32-)+c(HSO3-) B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
C.c(H2SO3)+c(H+)=c(SO32-)+c(OH-) D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
(3)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___.
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___.
(5)最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法(吸收液为Na2SO3溶液)可除去SO2.吸收SO2的过程中,pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,电解示意图如下:
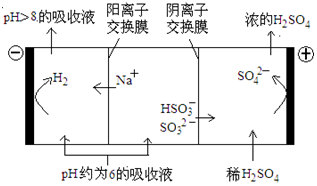
①写出阳极上发生的电极反应式___;
②当电极上有1mol电子转移时阴极产物的质量为___.
③已知:Ksp (BaSO4)=1.0×10-10,Ksp (BaSO3)=5.0×10-7.将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1.0×10-5 mol•L-1],此时溶液中c (SO32-)≤___mol•L-1.
(1)下列微粒可以大量共存的是___(填选项字母).
A.CO32-、HSO3-B. HCO3-、HSO3-C. SO32-、HCO3-D. H2SO3、HCO3-
(2)已知NaHSO3溶液显酸性,NaHSO3溶液中离子浓度关系不正确的是___(填序号).
A.c(Na+)=2c(SO32-)+c(HSO3-) B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
C.c(H2SO3)+c(H+)=c(SO32-)+c(OH-) D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
(3)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___.
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___.
(5)最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法(吸收液为Na2SO3溶液)可除去SO2.吸收SO2的过程中,pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,电解示意图如下:

①写出阳极上发生的电极反应式___;
②当电极上有1mol电子转移时阴极产物的质量为___.
③已知:Ksp (BaSO4)=1.0×10-10,Ksp (BaSO3)=5.0×10-7.将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1.0×10-5 mol•L-1],此时溶液中c (SO32-)≤___mol•L-1.
▼优质解答
答案和解析
(1)已知Ka越大酸性越强,酸性较强的能与酸性较弱的酸根离子反应,由于HCO3-的酸性小于HSO3-的酸性,所以HCO3-与SO32-不反应,即BC能共存,
故答案为:BC;
(2)在NaHSO3溶液中,电离程度大于水解程度,溶液显酸性,
A.由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),故A错误;
B.在NaHSO3溶液中,电离程度大于水解程度,溶液显酸性,则离子浓度为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故B正确;
C.根据质子守恒,c(H2SO3)+c(H+)═c(SO32-)+c(OH-),故C正确;
D.根据电荷守恒c(Na+)+c(H+)=2c(SO32-)+c((HSO3-)+c(OH-),故D正确;
故答案为:A;
(3)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,CO32-的水解程度大于SO32-,则生成的HCO3-浓度大于HSO3-的浓度,则离子浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
故答案为:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(4)H2SO3溶液和NaHCO3溶液反应生成二氧化碳和亚硫酸氢根离子,则反应的离子方程式为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
(5)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
②阴极上为阳离子H+得电子生成氢气,其电极反应式为:2H++2e-=H2↑,所以当电极上有1mol电子转移时,生成0.5mol氢气,即阴极产物的质量为1g,
故答案为:1g;
(6)根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
=
=10-5mol•L-1,则溶液中SO32-的最大浓度c(SO32-)=
=0.05mol•L-1,
故答案为:0.05.
故答案为:BC;
(2)在NaHSO3溶液中,电离程度大于水解程度,溶液显酸性,
A.由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),故A错误;
B.在NaHSO3溶液中,电离程度大于水解程度,溶液显酸性,则离子浓度为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故B正确;
C.根据质子守恒,c(H2SO3)+c(H+)═c(SO32-)+c(OH-),故C正确;
D.根据电荷守恒c(Na+)+c(H+)=2c(SO32-)+c((HSO3-)+c(OH-),故D正确;
故答案为:A;
(3)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,CO32-的水解程度大于SO32-,则生成的HCO3-浓度大于HSO3-的浓度,则离子浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
故答案为:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(4)H2SO3溶液和NaHCO3溶液反应生成二氧化碳和亚硫酸氢根离子,则反应的离子方程式为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
(5)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
②阴极上为阳离子H+得电子生成氢气,其电极反应式为:2H++2e-=H2↑,所以当电极上有1mol电子转移时,生成0.5mol氢气,即阴极产物的质量为1g,
故答案为:1g;
(6)根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
| Ksp(BaSO4) |
| c(SO42-) |
| 1×10-10 |
| 1×10-5 |
| Ksp(BaSO4) |
| c(Ba2+) |
故答案为:0.05.
看了 已知常温下,H2SO3的电离...的网友还看了以下:
已知圆x^2+y^2=3,过点P(1,3)作直线交于A,B两点,在AB上有一点Q,使向量PA=h向 2020-04-12 …
Matlab求帮忙看看哪里错了.h=0;%h[0,51.5]a=15;m=sMatlab求帮忙看看 2020-05-13 …
△h比较大小的问题当△h小于0的时候,是△h=-1大还是△h=-2大.这章才开始学,我就是不清楚这 2020-05-13 …
一个mathematica程序添加作图语句Clear[x,y,n,h,S1,S2,S3,S4,i] 2020-05-16 …
请问错在哪里,应如何改正>>v=0.7:1.2;>>h=0.1:0.5;>>[h,v]=meshg 2020-06-11 …
请教catalan数网上对catalan数的通项有两种说法一种说catalan数满足递归式:h(n 2020-06-28 …
用matlab解复杂方程组eq1=sym('(Tg-302)/(1/23.26+0.01/1.1) 2020-07-19 …
(解RICATTI方程)D=0.1;H=3.2;Ch=0.3;Kw=1;Kp=0.05;Tt=0.3 2020-10-31 …
请问怎么弄数学建模的灵敏度分析呢,下面这个程序要怎么改正?ft=@(h)((0.16-180)-(( 2020-11-08 …
设函数f(x)=e^x-1-x-ax^2若当x>=0时,f(x)>=0,求a的取值范围我做的过程是令 2020-12-27 …