早教吧作业答案频道 -->化学-->
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5.0mol.L-1NaOH溶液,生成沉淀的质量跟加入NaOH溶液的体积的关系如图所示.(横坐标体积的单位是mL,纵
题目详情
将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.
向所得溶液中滴加5.0mol.L-1NaOH溶液,生成沉淀的质量跟加入NaOH溶液的体积的关系如图所示.(横坐标体积的单位是mL,纵坐标质量的单位是g)
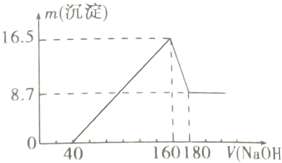
(1)NaOH溶液0-40 mL区间所发生反应的离子方程式为:___.
(2)NaOH溶液160-180mL区间所发生反应的离子方程式为:___.
(3)NaOH溶液滴加到160mL时,溶液中的溶质组成为___.
(4)合金中镁的质量为___g.
(5)所用盐酸的物质的量浓度为___ mol.L-1.
向所得溶液中滴加5.0mol.L-1NaOH溶液,生成沉淀的质量跟加入NaOH溶液的体积的关系如图所示.(横坐标体积的单位是mL,纵坐标质量的单位是g)

(1)NaOH溶液0-40 mL区间所发生反应的离子方程式为:___.
(2)NaOH溶液160-180mL区间所发生反应的离子方程式为:___.
(3)NaOH溶液滴加到160mL时,溶液中的溶质组成为___.
(4)合金中镁的质量为___g.
(5)所用盐酸的物质的量浓度为___ mol.L-1.
▼优质解答
答案和解析
(1)由图可知,从开始至加入NaOH溶液40mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,离子方程式为H++OH-=H2O,
故答案为:H++OH-=H2O;
(2)NaOH溶液160-180mL区间沉淀部分溶解,发生反应为:Al(OH)3+NaOH=NaAlO2+2H2O,其离子方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(3)根据图象曲线变化可知,加入40m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,反应后溶质为NaCl,
故答案为:NaCl;
(4)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,根据图象可知,氢氧化铝和氢氧化镁的总质量为16.5g,
加入180mL氢氧化钠溶液时,剩余的8.5g沉淀为氢氧化镁,n[Mg(OH)2]=
=0.15mol
由元素守恒可知:n(Mg)=n[Mg(OH)2]=0.15mol,
所以Mg的质量为:0.15mol×24g/mol=3.6g,
故答案为:3.6;
(5)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为NaCl溶液,
根据钠元素守恒此时溶液中:n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,
根据氯元素守恒n(HCl)=0.8mol,
故盐酸的物质的量浓度为:
=8mol/L,
答:盐酸的物质的量浓度为8mol/L.
故答案为:H++OH-=H2O;
(2)NaOH溶液160-180mL区间沉淀部分溶解,发生反应为:Al(OH)3+NaOH=NaAlO2+2H2O,其离子方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(3)根据图象曲线变化可知,加入40m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,反应后溶质为NaCl,
故答案为:NaCl;
(4)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,根据图象可知,氢氧化铝和氢氧化镁的总质量为16.5g,
加入180mL氢氧化钠溶液时,剩余的8.5g沉淀为氢氧化镁,n[Mg(OH)2]=
| 7.8g |
| 58g/mol |
由元素守恒可知:n(Mg)=n[Mg(OH)2]=0.15mol,
所以Mg的质量为:0.15mol×24g/mol=3.6g,
故答案为:3.6;
(5)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为NaCl溶液,
根据钠元素守恒此时溶液中:n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,
根据氯元素守恒n(HCl)=0.8mol,
故盐酸的物质的量浓度为:
| 0.8mol |
| 0.1L |
答:盐酸的物质的量浓度为8mol/L.
看了 将一定质量的镁铝合金投入20...的网友还看了以下:
就是物质的量浓度与密度溶质质量分数之间的关系是什么就是说如果一个溶液的物质的量浓度高能推导出密度溶质 2020-03-30 …
10克硝酸钾溶于90克水中,将此溶液均匀分成四份,1)一份溶液的百分比浓度()2).往一份溶液中加入 2020-03-30 …
物质在水中的溶解度溶解度的四要素:条件标准溶解状态单位2.溶解度的意义:3.固体物质溶解度与温度变 2020-04-08 …
关于溶解度、计算溶解度的问题摁--溶解度不是一定温度下,100g溶剂中所含溶质的多少么?那么如果计 2020-04-09 …
第一题的第二小题,求硝酸钾的溶解度.溶解度怎么求?是溶质的质量分数吗? 第一题的第二小题,求硝酸钾 2020-05-16 …
如果增加温度溶液的溶解度会不会一直升高比如浓硫酸溶入水中会导致水的温度提高,而温度提高意味着水的溶 2020-05-16 …
溶解度,指的是在一定温度下,100克溶剂达到饱和状态时所溶解的溶质的质量,这很明显讲的就是个溶质的 2020-05-17 …
j表二是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:温度(℃)20一0j05060溶解度(g 2020-07-09 …
下表列出了NO的部分物理性质和化学性质:物理性质化学性质熔点沸点密度溶解性-163.64℃-151 2020-07-18 …
以下是三种气体的密度(O℃、101kPa)和溶解度(20℃、lOlkPa).气体性质H2CO2S02 2020-11-02 …