早教吧作业答案频道 -->化学-->
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.(1)阴影部分元素P在元素周期表中的位置为.根据元素周期律,预测:酸性强弱H3PO4H3AsO4
题目详情
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
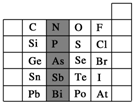
(1)阴影部分元素P在元素周期表中的位置为___.根据元素周期律,预测:酸性强弱H3PO4___ H3AsO4.(用“>”“<”或“=”表示)
(2)已知阴影部分As元素的原子核内质子数为33,则Sn2+的核外电子数为___.
(3)下列说法正确的是___.
A.C、N、O、F的原子半径随着原子序数的增大而增大
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.对于短周期元素,两种简单离子不可能相差3个电子层
D.HF、HCl、HBr、HI的还原性依次减弱.

(1)阴影部分元素P在元素周期表中的位置为___.根据元素周期律,预测:酸性强弱H3PO4___ H3AsO4.(用“>”“<”或“=”表示)
(2)已知阴影部分As元素的原子核内质子数为33,则Sn2+的核外电子数为___.
(3)下列说法正确的是___.
A.C、N、O、F的原子半径随着原子序数的增大而增大
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.对于短周期元素,两种简单离子不可能相差3个电子层
D.HF、HCl、HBr、HI的还原性依次减弱.
▼优质解答
答案和解析
(1)由P元素在周期表中的位置可知,处于第三横行、15列,故N元素处于第二周期ⅤA族;
同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3PO4>H3AsO4,
故答案为:第三周期ⅤA族;>;
(2)As元素的原子核内质子数为33,则Sn原子序数为33-1+18=50,Sn2+的核外电子数为50-2=48,
故答案为:48;
(3)A.同周期自左而右原子半径减小,故C、N、O、F的原子半径随着原子序数的增大而减小,故A错误;
B.同周期自左而右非金属性增强,故Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强,故B正确;
C.对于短周期元素,两种简单离子可能相差3个电子层,如H+与S2-、Cl-,故C错误;
D.非金属性F>Cl>Br>I,非金属性越强,氢化物还原性越弱,HF、HCl、HBr、HI的还原性依次增强,故D错误,
故选:B.
同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3PO4>H3AsO4,
故答案为:第三周期ⅤA族;>;
(2)As元素的原子核内质子数为33,则Sn原子序数为33-1+18=50,Sn2+的核外电子数为50-2=48,
故答案为:48;
(3)A.同周期自左而右原子半径减小,故C、N、O、F的原子半径随着原子序数的增大而减小,故A错误;
B.同周期自左而右非金属性增强,故Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强,故B正确;
C.对于短周期元素,两种简单离子可能相差3个电子层,如H+与S2-、Cl-,故C错误;
D.非金属性F>Cl>Br>I,非金属性越强,氢化物还原性越弱,HF、HCl、HBr、HI的还原性依次增强,故D错误,
故选:B.
看了 元素在周期表中的位置,反映了...的网友还看了以下:
下表是元素周期表短周期的一部分①②③④⑤⑥⑦(1)①-⑦元素中金属性最强的元素位于周期表第周期族. 2020-04-08 …
已知铜锈的主要成分是碱式碳酸铜化学式为[Cu2(OH)2CO3],则该物质中元素的质量分数最大,各 2020-04-11 …
计算下列物质的相对原子质量KClO3KMnO4H2SO4Ca3(PO4)2Ba(NO3)2H2Ca 2020-05-12 …
某种含有MgBr和MgO的混合物,经分析测得Mg元素的质量分数为38.4%,求Br元素的质量分数. 2020-05-12 …
按元素周期表的排列规律填写如表空格中元素的原子序数、元素符号、元素名称,并回答下列问题:原子序数元 2020-05-13 …
《世说新语中《陈太丘与友期》中元方的做法正确嘛?有人说元方做法很妥当,应该坚持原则;有的人说元方的 2020-05-15 …
共价化合物中元素的化合价共价化合物中电子是不是偏向电荷高的原子?是不是电荷高的原子一定显负价? 2020-05-17 …
关于化学的元素周期表的一个问题元素周期表中元素的排列依据原来是按相对原子质量排列,后来改成了原子的 2020-05-20 …
1.同族中元素的核电荷数有怎样的变化?2.从He原子到Ar原子,原子半径依次增大的原因是什么? 2020-06-05 …
设P,Q为两个数集,P中含有0,2,5三个元素,Q中含有1,2,6三种元素,定义集合P+Q中的元素 2020-06-12 …