早教吧作业答案频道 -->化学-->
利用氨气脱硝(除NO)是大气污染防治研究的热点,脱硝过程中涉及的反应为:主反应:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)副反应:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/m
题目详情
利用氨气脱硝(除NO)是大气污染防治研究的热点,脱硝过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
②4NH3(g)+4O2(g)⇌2N2O(g)+6H2O(g)△H=-1104.9kJ/mol
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol
回答下列问题:
(1)主反应的△H为___
(2)若NH3的初始物质的量为m mol,达到平衡后生成水蒸气的物质的量为n mol,则NH3总平衡转化率为___(写出表达式)
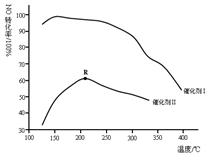
(3)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
①选用催化剂I的优势有___(写出一点)
②R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由___.
(4)常温下,在通入氧气的条件下用0.1mol/L的NaOH溶液吸收NO也可实现脱硝(产物主要为NaNO3 和NaNO2),已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数为5.1×10-4),则:
①
=___mol/L
②反应后溶液中NO3-的浓度约为___mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L的硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀___【Ksp(AgNO2)=2×10-8】
主反应:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
②4NH3(g)+4O2(g)⇌2N2O(g)+6H2O(g)△H=-1104.9kJ/mol
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol
回答下列问题:

(1)主反应的△H为___
(2)若NH3的初始物质的量为m mol,达到平衡后生成水蒸气的物质的量为n mol,则NH3总平衡转化率为___(写出表达式)
(3)如图所示,保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示:
①选用催化剂I的优势有___(写出一点)
②R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由___.
(4)常温下,在通入氧气的条件下用0.1mol/L的NaOH溶液吸收NO也可实现脱硝(产物主要为NaNO3 和NaNO2),已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数为5.1×10-4),则:
①
c(N
| ||
| c(HNO2) |
②反应后溶液中NO3-的浓度约为___mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L的硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀___【Ksp(AgNO2)=2×10-8】
▼优质解答
答案和解析
(1)①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol,③×2-①得4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g),故主反应的△H=(-1269.0kJ/mol)×2-(-905.5kJ/mol)=-1632.5kJ/mol,
故答案为:-1632.5kJ/mol;
(2)消耗的n(NH3)=
n(H2O)=
n,故NH3总平衡转化率=
×100%=
×100%,
故答案为:
×100%;
(3)①选用催化剂I的优势有:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源,
故答案为:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源;
②观察图象不难发现,低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
故答案为:低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
(4)①HNO2⇌H++NO2-,则Ka=
,故
=
×c(OH-)=
×10-2=5.1×106,
故答案为:5.1×106;
②根据电荷守恒式:c(H+)+c(Na+)=c(NO3-)+c(NO2-)+c(OH-),可知c(NO3-)=c(H+)+c(Na+)-c(NO2-)-c(OH-)=10-12mol/L+0.1mol/L-5.6
×10-2mol/L-10-2mol/L≈0.1mol/L-5.6×10-2mol/L-10-2mol/L=0.034mol/L,
故答案为:0.034;
③滴入硝酸银溶液后:
c(NO2-)≈1.0×10-6mol/L,c(Ag+)=
≈1.0×10-3mol/L,Qc=c(NO2-)×c(Ag+)≈1.0×10-6×1.0×10-3=1.0×10-9<2×10-8,故不能生成沉淀,
故答案为:不能.
③4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1269.0kJ/mol,③×2-①得4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g),故主反应的△H=(-1269.0kJ/mol)×2-(-905.5kJ/mol)=-1632.5kJ/mol,
故答案为:-1632.5kJ/mol;
(2)消耗的n(NH3)=
| 2 |
| 3 |
| 2 |
| 3 |
| n反 |
| n原 |
| ||
| m |
故答案为:
| ||
| m |
(3)①选用催化剂I的优势有:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源,
故答案为:催化剂I在低温下就能使主反应NO的转化率很高,若使用此催化剂脱硝,更有利于节约能源;
②观察图象不难发现,低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
故答案为:低于210℃时,NO的转化率随温度升高而增大,而主反应为放热反应,升高温度向逆反应进行,则NO的平衡转化率应随温度升高而降低,与平衡移动得到的结论不一致,故该温度范围内NO的转化率都是非平衡转化率,
(4)①HNO2⇌H++NO2-,则Ka=
| c(H+)c(NO2-) |
| c(HNO2) |
c(N
| ||
| c(HNO2) |
| Ka |
| c(H+) |
| 5.1×10-4 |
| 10-12 |
故答案为:5.1×106;
②根据电荷守恒式:c(H+)+c(Na+)=c(NO3-)+c(NO2-)+c(OH-),可知c(NO3-)=c(H+)+c(Na+)-c(NO2-)-c(OH-)=10-12mol/L+0.1mol/L-5.6
×10-2mol/L-10-2mol/L≈0.1mol/L-5.6×10-2mol/L-10-2mol/L=0.034mol/L,
故答案为:0.034;
③滴入硝酸银溶液后:
c(NO2-)≈1.0×10-6mol/L,c(Ag+)=
| 0.1mol/L×0.00005L |
| 0.00505L |
故答案为:不能.
看了 利用氨气脱硝(除NO)是大气...的网友还看了以下:
薄膜干涉时,发生干涉的两列光的路程差A.等于入射处薄膜的厚度B.等于入射处薄膜厚度的两倍C.与观察 2020-05-14 …
校泥泞阿三啥都1.若(3x+2)(x-1)-(x+3)(5x-6)=(无需过程O(∩∩)O~)2. 2020-05-16 …
28和2010是神秘数吗?为什么?过程,O(∩∩)O谢谢,十分钟之内加分 2020-05-23 …
谁能给我出102道解方程,请写好计算过程,O(∩∩)O谢谢!十万火急啊!我想要的是102道(50几 2020-05-23 …
答出者我愿悬赏100,绝不反悔1,双缝干涉实验中如果光程差既不是波长的整数倍也不是半波长的奇数倍, 2020-06-03 …
分析光干涉的问题在分析光的干涉问题时,为什么要用光程差而不用路程差? 2020-06-10 …
迈克尔干涉仪实验中的问题1、观察等倾和等厚干涉的先决条件是什么?为什么在观察到等倾干涉后,在不改变 2020-06-12 …
阅读下面的文字,完成下列各题。逻辑探求负载知识的前提与结论之间的联系,不涉及具体的科学发现却涉及科 2020-06-27 …
已知圆M的方程为:x²+y²-2x-2y-6=0,以坐标原点为圆心的圆O与圆M相切已知圆M的方程为 2020-06-27 …
谁能给出等倾干涉光程差详细推导过程 2020-06-30 …