早教吧作业答案频道 -->化学-->
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5KJ•mol-1H2(g)+12O2(g)═H2O(g)△H=-241.8KJ•mol-1CO(
题目详情
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5KJ•mol-1
H2(g)+
O2(g)═H2O(g)△H=-241.8KJ•mol-1
CO(s)+
O2(g)═CO2(g)△H=-283.0KJ•mol-1
则煤气化主要反应C(s)+H2O (g)═CO(g)+H2(g)的△H=___
(2)已知CO(g)+O2(g)═CO2(g)+O(g)的正反应速率为v正=k正•c(CO)•c(O2),逆反应速率为v逆=k逆•c(CO2)•c(O),k为速率常数.2500K时,k正=1.21×105 L/mol,k逆=3.02×105L/mol,则该温度下的反应平衡常数K=___
(3)甲醇制甲醚的有关反应为:2CH3OH (g)═CH3OCH 3(g)+H2O (g).一定温度下,在三个容积均为1.0L的恒容密闭容器中发生该反应.
①x/y=___
②已知387℃时该反应的化学平衡常数K=4.该温度下,若起始时向容器Ⅰ中冲入0.10molCH3OH (g)、0.15mol CH3OCH3(g)和0.10mol H2O(g),则反应将向___(填“正”或“逆”)反应方向进行.
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为___.(填序号)
A.升高温度
B.降低温度
C.其他条件不变,增加CH3OH 的物质的量
D.保持其他条件不变,通入氖气
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示.
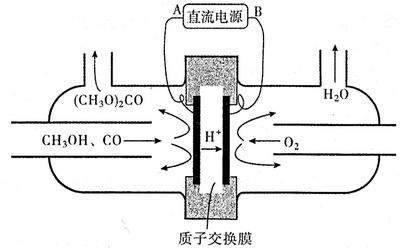
则电源的负极为___(填“A”或“B”),写出阳极的电极反应式:___
(5)将化石燃料的燃烧产物CO2通入NaOH溶液中可制得碳酸氢钠.取0.2mol/L碳酸钠溶液与0.2mol/L氯化钡溶液等体积混合产生浑浊,请结合一下数据,通过计算说明产生浑浊的原因:[已知:25℃时,0.1mol/L碳酸氢钠溶液中碳酸根离子的浓度为0.0011mol/L,Ksp(BaCO3)=5.1×10-9].
(1)已知:C(s)+O2(g)═CO2(g)△H=-393.5KJ•mol-1
H2(g)+
| 1 |
| 2 |
CO(s)+
| 1 |
| 2 |
则煤气化主要反应C(s)+H2O (g)═CO(g)+H2(g)的△H=___
(2)已知CO(g)+O2(g)═CO2(g)+O(g)的正反应速率为v正=k正•c(CO)•c(O2),逆反应速率为v逆=k逆•c(CO2)•c(O),k为速率常数.2500K时,k正=1.21×105 L/mol,k逆=3.02×105L/mol,则该温度下的反应平衡常数K=___
(3)甲醇制甲醚的有关反应为:2CH3OH (g)═CH3OCH 3(g)+H2O (g).一定温度下,在三个容积均为1.0L的恒容密闭容器中发生该反应.
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.该温度下,若起始时向容器Ⅰ中冲入0.10molCH3OH (g)、0.15mol CH3OCH3(g)和0.10mol H2O(g),则反应将向___(填“正”或“逆”)反应方向进行.
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为___.(填序号)
A.升高温度
B.降低温度
C.其他条件不变,增加CH3OH 的物质的量
D.保持其他条件不变,通入氖气
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示.

则电源的负极为___(填“A”或“B”),写出阳极的电极反应式:___
(5)将化石燃料的燃烧产物CO2通入NaOH溶液中可制得碳酸氢钠.取0.2mol/L碳酸钠溶液与0.2mol/L氯化钡溶液等体积混合产生浑浊,请结合一下数据,通过计算说明产生浑浊的原因:[已知:25℃时,0.1mol/L碳酸氢钠溶液中碳酸根离子的浓度为0.0011mol/L,Ksp(BaCO3)=5.1×10-9].
▼优质解答
答案和解析
(1)已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
③CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol,
根据盖斯定律,①-②×
-③可得:C(s)+H2O(g)═CO(g)+H2(g),
故△H=-393.5kJ/mol-(-483.6kJ/mol)×
-(-283kJ/mol)=+131.3 kJ/mol,
故答案为:+131.3 kJ/mol;
(2)平衡常数K=
=
=
=0.40,故答案为:0.40;
(3)①Ⅱ等效为在I的基础上压强增大一倍,反应前后气体体积不变,平衡不移动,反应物转化率不变,设转化率为a,则x=2a,y=4a,故
=
,
故答案为:
;
②浓度商Qc=
=1.5<K=4,故反应向正反应进行,
故答案为:正;
③207℃时,平衡时甲醚与水均为0.09mol,则消耗的甲醇为0.18mol,平衡时甲醇为0.02mol,则平衡常数K=
=20.25,大于387℃时平衡常数,说明降低温度平衡向正反应进行,故正反应为放热反应,容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可在温度方面的措施为:降低温度,
故答案为:B;
(4)由结构示意图可知,电解池左侧发生氧化反应、右侧发生还原反应,则电解池左侧为阳极,连接电源的正极,右侧为阴极,连接电源的负极,B为电源的负极,阳极是甲醇、CO失去电子生成(CH3O)2CO与氢离子,电极反应式为:2CH3OH+CO-2e-=(CH3O)2CO+2H+,
故答案为:B;2CH3OH+CO-2e-=(CH3O)2CO+2H+;
(5)两种溶液等体积混合后,溶液中钡离子浓度=
=0.1mol/L,0.1 mol•L-1 NaHC03溶液电离出的c(CO32-)为0.0011 mol•L-1,故Q=Q=c(Ba2+)×c(CO32-)=
×0.0011=1.1×10-4>5.1×10-9,故会产生沉淀,
答:Q=c(Ba2+)×c(CO32-)=
×0.0011=1.1×10-4>5.1×10-9.
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
③CO(g)+
| 1 |
| 2 |
根据盖斯定律,①-②×
| 1 |
| 2 |
故△H=-393.5kJ/mol-(-483.6kJ/mol)×
| 1 |
| 2 |
故答案为:+131.3 kJ/mol;
(2)平衡常数K=
| c(CO2)•c(O) |
| c(CO)•c(O2) |
| k正 |
| k逆 |
| 1.21×105L/mol |
| 3.02×105L/mol |
(3)①Ⅱ等效为在I的基础上压强增大一倍,反应前后气体体积不变,平衡不移动,反应物转化率不变,设转化率为a,则x=2a,y=4a,故
| x |
| y |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
②浓度商Qc=
| 0.15×0.1 |
| 0.12 |
故答案为:正;
③207℃时,平衡时甲醚与水均为0.09mol,则消耗的甲醇为0.18mol,平衡时甲醇为0.02mol,则平衡常数K=
| 0.09×0.09 |
| 0.022 |
故答案为:B;
(4)由结构示意图可知,电解池左侧发生氧化反应、右侧发生还原反应,则电解池左侧为阳极,连接电源的正极,右侧为阴极,连接电源的负极,B为电源的负极,阳极是甲醇、CO失去电子生成(CH3O)2CO与氢离子,电极反应式为:2CH3OH+CO-2e-=(CH3O)2CO+2H+,
故答案为:B;2CH3OH+CO-2e-=(CH3O)2CO+2H+;
(5)两种溶液等体积混合后,溶液中钡离子浓度=
| 0.2mol/L |
| 2 |
| 0.2 |
| 2 |
答:Q=c(Ba2+)×c(CO32-)=
| 0.2 |
| 2 |
看了 能源是国民经济发展的重要基础...的网友还看了以下:
一道高数函数连续性的问题!谢谢!设f(x)在x0连续,g(x)在x0不连续,则在x0处()A.f( 2020-06-06 …
工业生产水煤气的反应为:C(s)+H2O(g)CO(g)+H2(g)ΔH=+131.4kJ·mol 2020-07-17 …
已知下列反应的焓变为:H2(g)+I2(s)=HI(g)ΔrH=25.9kJ·mol-1H2(g) 2020-07-19 …
(4分)已知:C(s)+O2(g)CO2(g)ΔH="-437.3"kJ·mol一1H2(g)+O 2020-07-19 …
(1)已知:H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8kJ·mol-1H2(g) 2020-07-19 …
反应A(g)+B(g)—→C(g)ΔH,分两步进行:①A(g)+B(g)—→X(g)ΔH1;②X(g 2020-10-31 …
反应A(g)+B(g)―→C(g)ΔH,分两步进行:①A(g)+B(g)―→X(g)ΔH1;②X(g 2020-10-31 …
反应A(g)+B(g)―→C(g)ΔH,分两步进行:①A(g)+B(g)―→X(g)ΔH1②X(g) 2020-10-31 …
用键能可以估算反应热,当以键能来估算反应热时,下列方程式符合要求的是A.CH3COOH(L)+C2H 2020-11-03 …
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)CO(g)+H2(g);C(s)、CO(g)和 2020-11-20 …