早教吧作业答案频道 -->化学-->
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.实验步骤:将一定量FeSO4固体置于硬质玻璃管中,打开
题目详情
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.
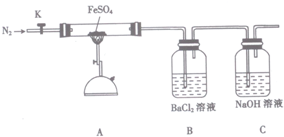
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N.
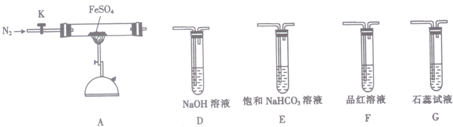
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N.

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.44

42
操作步骤 实验现象 用化学方程式解释原因 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 洗气瓶B中① ___ ② ___ A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 硬质玻璃管中最终可以看到③ ___ ④ ___ 操作步骤 实验现象 用化学方程式解释原因 操作步骤 实验现象 用化学方程式解释原因 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 洗气瓶B中① ___ ② ___ 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 2洗气瓶B中① ___ ② ___ A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 硬质玻璃管中最终可以看到③ ___ ④ ___ A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 硬质玻璃管中最终可以看到③ ___ ④ ___


实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中① ___ | ② ___ |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③ ___ | ④ ___ |

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为___.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中① ___ | ② ___ |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③ ___ | ④ ___ |

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→___→___.
②能证明生成了非金属氧化物N的现象是___.44

42
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中① ___ | ② ___ |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③ ___ | ④ ___ |

▼优质解答
答案和解析
(1)硫酸亚铁(FeSO44)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物,金属氧化物为铁的氧化物,铁元素70%,氧元素占30%,铁元素和氧元素物质的量之比=
:
=2:3,化学式为Fe2O3,
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑,
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
70% 56 70% 70% 70%56 56 56:
=2:3,化学式为Fe2O3,
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑,
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
30% 16 30% 30% 30%16 16 16=2:3,化学式为Fe22O33,
故答案为:Fe22O33;
(2)硫酸亚铁(FeSO44)加热至高温会分解,生成一种金属氧化物M为Fe22O33和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO22、SO33生成,打开K,通入一段时间的N22,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO33+H22O+BaCl22=BaSO44↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO44
Fe2O3+SO2↑+SO3↑,
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
高温 高温 高温 高温 Fe22O33+SO22↑+SO33↑,
故答案为:①有白色沉淀生成;②SO33+H22O+BaCl22=BaSO44↓+2HCl;③有红棕色固体物质生成;④2FeSO44
Fe2O3+SO2↑+SO3↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
高温 高温 高温 高温 Fe22O33+SO22↑+SO33↑;
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO22,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| 70% |
| 56 |
| 30% |
| 16 |
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
| ||
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| 70% |
| 56 |
| 30% |
| 16 |
故答案为:Fe2O3;
(2)硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M为Fe2O3和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO2、SO3生成,打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO3+H2O+BaCl2=BaSO4↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO4
| ||
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| 30% |
| 16 |
故答案为:Fe22O33;
(2)硫酸亚铁(FeSO44)加热至高温会分解,生成一种金属氧化物M为Fe22O33和两种非金属氧化物,发生了氧化还原反应,则非金属氧化物应为SO22、SO33生成,打开K,通入一段时间的N22,关闭活塞K,加热A中的玻璃管一段时间洗气瓶B中会生成白色沉淀,三氧化硫通入氯化钡溶液生成硫酸钡沉淀,反应的化学方程式为:SO33+H22O+BaCl22=BaSO44↓+2HCl,A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,硬质玻璃管中最终可以看到有红色固体生成,反应的化学方程式为:2FeSO44
| ||
故答案为:①有白色沉淀生成;②SO3+H2O+BaCl2=BaSO4↓+2HCl;③有红棕色固体物质生成;④2FeSO4
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| ||
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
.
.
.
.
.故答案为:①有白色沉淀生成;②SO33+H22O+BaCl22=BaSO44↓+2HCl;③有红棕色固体物质生成;④2FeSO44
| ||
(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO2,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
| ||
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
| 高温 |
. |
.
.
.
.
.(3)①验证硫酸亚铁分解产物中含有的另一种非金属氧化物N为SO22,二氧化硫遇到品红溶液会褪色,所以检验二氧化硫气体可以用品红溶液检验二氧化硫的存在,二氧化硫是污染性气体,需要最后用氢氧化钠溶液吸收,选择装置为FD,
故答案为:F;D;
②能证明生成了非金属氧化物N的现象是:F中品红溶液褪色,
故答案为:F中品红溶液褪色.
看了 硫酸亚铁(FeSO4)加热至...的网友还看了以下:
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用 2020-05-02 …
某ph=1的氯化锌和氯化氢的混合溶液含有氯化铁杂质,为了除去氯化铁杂质,需将溶液调至ph=4,在调 2020-05-13 …
小明实验小组分别用蜡和某种物质来探究固体熔化时温度的变化规律。(1)为了方便测出蜡熔化时的温度,在 2020-07-06 …
硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物。某化学研究小组利用 2020-07-11 …
下列说法正确的是()①正常雨水的pH为7.0,酸雨的pH小于7.0②严格执行机动车尾气排放标准有利 2020-07-12 …
下图是全球风电装机容量和发电成本变化图和某区域风能资源分布图。(14分)(1)进入21世纪,世界各 2020-07-29 …
如图是全球风电装机容量和发电成本变化图和某区域风能资源分布图.(1)进入21世纪,世界各国更加重视 2020-07-29 …
E-51环氧树脂凝胶时间测定,铜板法用铜板测定,树脂和某种固化剂按一定比例混合成混合物,加热铜板到某 2020-11-29 …
下图是北半球某城市在春分、夏至和冬至三天正午太阳高度变化示意图,指出下列排序与图中相符的是A.①夏至 2020-12-07 …
四氧化三铁能否和氧化铁相互转化拜托了各位四氧化三铁于某物质反应能否生成氧化铁或氧化铁和某物质反应能否 2020-12-31 …