某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:①CH4(g)+H2O(g)CO(g)+3H2(g)ΔH1=+206.1kJ·mol-1
某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH 4 (g)+H 2 O(g)CO(g)+3H 2 (g) Δ H 1 =+206.1 kJ·mol -1
②CH 4 (g)+CO 2 (g)2CO(g)+2H 2 (g) ΔH 2 =+247.3 kJ·mol -1
③CO(g)+H 2 O(g)CO 2 (g)+H 2 (g) Δ H 3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH 4 的物质的量浓度随反应时间的变化如图1所示。
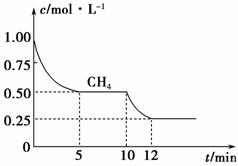
图1
反应进行的前5 min内, v (H 2 )=________;10 min时,改变的外界条件可能是______________________________________________________________。
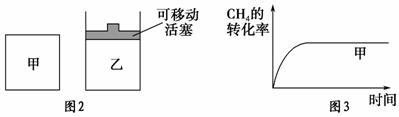
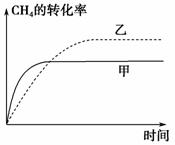
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH 4 和CO 2 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH 4 的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH 4 的转化率随时间变化的图像。
(3)反应③中Δ H 3 =________。800 ℃时,反应③的平衡常数 K =1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
| CO | H 2 O | CO 2 | H 2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是________(填代号)。
a. v 正 > v 逆 B. v 正 < v 逆
c. v 正 = v 逆 D.无法判断
(4)用该合成气制取甲醚的化学方程式为______________________________。
该反应的原子利用率为________(设反应完全进行,用质量百分比表示)。
解析 (1)可根据图像先计算CH 4 的反应速率,再计算H 2 的生成速率。10 min时,改变的条件不可能是增大容器的体积(否则改变条件的瞬间CH 4 浓度应突然减小),由于 c (CH 4 )减小,平衡右移,故改变的条件可能是升高温度(或充入水蒸气)。(2)甲容器反应开始后压强增大,乙容器压强不变、体积增大,可看成是由甲减压得到乙,故乙容器的反应速率慢,平衡右移,CH 4 的转化率大。(3)根据盖斯定律,反应①减去反应②即可得到反应③,进而通过计算求得Δ H 3 。根据浓度商: 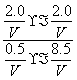 =0.94< K =1,可知反应向正反应方向进行,即
=0.94< K =1,可知反应向正反应方向进行,即
v 正 > v 逆 。(4)根据质量守恒定律可知,反应的化学方程式为2CO+4H 2 ===CH 3 OCH 3 +H 2 O,可以求出甲醚质量占反应物总质量的71.9%。
答案 (1)0.3 mol·L -1 ·min -1 升高温度(或充入水蒸气)
(2)
(3)-41.2 kJ·mol -1 a
(4)2CO+4H 2 ===CH 3 OCH 3 +H 2 O 71.9%
已知25℃、101kPa条件下:4Al(s)+3O2(g)==2Al2O3(s);△H=-2834 2020-05-13 …
下列关于在人体细胞呼吸过程中,[H]的来源于用途的叙述,最准确的是呼吸类型[H]的来源[H]的用途 2020-05-14 …
上山的速度3240m/h,下山速度6440m/h,共用6小时完成旅程,求上山下山各用了多少时间, 2020-05-20 …
巨桉原产澳大利亚东部沿海,广泛用于地工造林,具有适应性强和经济价值高h特点.菊苣是生长在林下h、高 2020-06-15 …
1.一个物体从H高处自由下落,经过最后196M用的时间是4S,求H及物体下落H所用的总时间T.(g 2020-07-18 …
某芳香族化合物H常用作防腐剂,H可利用下列路线合成:已知:①A是相对分子质量为92的烃;(-R1、 2020-07-21 …
经测定,在任何水溶液中,均存在一定数量的H+〔用n(H+)表示〕和一定数量的OH-〔用n(OH-) 2020-07-25 …
下列关于有氧呼吸和无氧呼吸的叙述错误的是()A.有氧呼吸第一、二阶段产生的[H],用于第三阶段与O2 2020-11-11 …
(大717•徐州三模)硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸.已知:①七七7℃时, 2020-11-11 …
图中是用围棋子摆成的字母“H”,摆第一个“H”用了7枚棋子,摆第二个“H”用了口2枚棋子,…,那么摆 2021-02-09 …