早教吧作业答案频道 -->化学-->
(1)氨在国民经济中占有重要地位.工业合成氨的反应原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.①若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q184.8kJ(填
题目详情
(1)氨在国民经济中占有重要地位.
工业合成氨的反应原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q___184.8kJ(填“>”、“<”或“=”).
②已知:
1mol N-H键断裂吸收的能量为___kJ.
③某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内该反应的平均速率v(H2)=___mol•L-1•min-1,该温度下反应的平衡常数K=___.欲增大氮气的平衡转化率,可采取的措施有___(写一种措施即可).
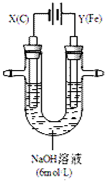
(2)某课外小组用如图所示装置对电解原理进行实验探究.用右图所示装置进行实验.实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
①电解过程中,X极区溶液的pH___(填“增大”、“减小”或“不变”).
②电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-═FeO42-+4H2O和___.
③若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___g.
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为___.
工业合成氨的反应原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q___184.8kJ(填“>”、“<”或“=”).
②已知:

1mol N-H键断裂吸收的能量为___kJ.
③某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内该反应的平均速率v(H2)=___mol•L-1•min-1,该温度下反应的平衡常数K=___.欲增大氮气的平衡转化率,可采取的措施有___(写一种措施即可).
(2)某课外小组用如图所示装置对电解原理进行实验探究.用右图所示装置进行实验.实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
①电解过程中,X极区溶液的pH___(填“增大”、“减小”或“不变”).
②电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-═FeO42-+4H2O和___.
③若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___g.
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为___.

▼优质解答
答案和解析
①反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,生成的氨气小于2mol,故达平衡后放出的热量小于184.4 kJ;
故答案为:<;
②3H2+N2⇌2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391KJ;
故答案为:391;
③N2(g)+3H2(g)⇌2NH3(g)
初始浓度:1 2.8 0
变化浓度:0.6 1.8 1.2
平衡浓度:0.4 1.0 1.2
则10min内该反应的平均速率v(H2)=
=0.18mol/(L•min),K=
=
=3.6,欲增大氮气的平衡转化率,可以增大压强、增加氢气的浓度、移走氨气、降温等,
故答案为:0.18;3.6;增大压强、增加氢气的浓度、移走氨气、降温;
(2)①电解过程中,X电极上电极反应式为2H2O+2e-=H2↑+2OH-,所以c(OH-)增大,溶液的pH增大,故答案为:增大;
②Y电极上还发生的反应为Fe失电子和氢氧根离子反应生成高铁酸根离子和水,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③X电极收集的气体是氢气,n(H2)=
=0.03mol,Y电极析出氧气的物质的量=
=0.0075mol,根据转移电子相等得铁溶解的质量=
×56g/mol=0.28g,
故答案为:0.28;
④正极上高铁酸根离子得电子和水反应生成氧化铁和氢氧根离子,电极反应式为2FeO42-+6e-+5H2O=Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O=Fe2O3+10OH-.
故答案为:<;
②3H2+N2⇌2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391KJ;
故答案为:391;
③N2(g)+3H2(g)⇌2NH3(g)
初始浓度:1 2.8 0
变化浓度:0.6 1.8 1.2
平衡浓度:0.4 1.0 1.2
则10min内该反应的平均速率v(H2)=
| 1.8mol/L |
| 10min |
| c 2(NH 3) |
| c(N 2)c 3(H 2) |
| 1.22 |
| 0.4×1.03 |
故答案为:0.18;3.6;增大压强、增加氢气的浓度、移走氨气、降温;
(2)①电解过程中,X电极上电极反应式为2H2O+2e-=H2↑+2OH-,所以c(OH-)增大,溶液的pH增大,故答案为:增大;
②Y电极上还发生的反应为Fe失电子和氢氧根离子反应生成高铁酸根离子和水,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③X电极收集的气体是氢气,n(H2)=
| 0.672L |
| 22.4L/mol |
| 0.168L |
| 22.4L/mol |
| 0.03mol×2-0.0075mol×4 |
| 6 |
故答案为:0.28;
④正极上高铁酸根离子得电子和水反应生成氧化铁和氢氧根离子,电极反应式为2FeO42-+6e-+5H2O=Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O=Fe2O3+10OH-.
看了 (1)氨在国民经济中占有重要...的网友还看了以下:
一个等效平衡题某温度下密闭容器中发生如下可逆反应2E[g]==F[g]+xG[g]若起始时E的浓度 2020-06-06 …
如果保持温度不变继续向该平衡体系中通入1.0mol的B(g),相同条件下反应达到新的平衡状态,则A 2020-06-06 …
化学平衡常数与投料有关么.我自己想的.对于反应温度不变M(g)+N(g)=P(g)+Q(g)一起始 2020-06-24 …
按要求书写热化学方程式:①1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2k 2020-07-19 …
化学反应原理是中学化学学习的重要内容.请回答下列问题:(1)下列判断正确的是.①CH4(g)+2O 2020-07-22 …
是悖论么?对桌面的压力不等于重力?不规则容器里乘上水放在桌面上,对桌面的压力=ρgh×S+G容器, 2020-07-24 …
(2013•泰州二模)在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.(1)若在恒温恒 2020-11-12 …
化学关于化学平衡的计算题将等物质的量的H2(g)与I2(g)放入密闭容器中进行反应:H2(g)+I2 2021-01-22 …
请用热化学方程式表示(1)1molN2(g)与适量H2(g)起反应,生成2molNH3(g),放出9 2021-02-16 …
依据事实,写出下列反应的热化学方程式.(1)1molN2(g)与适量H2(g)起反应,生成NH3(g 2021-02-16 …