早教吧作业答案频道 -->化学-->
氮及氮的化合物在化工研究中是一门重要的课题.I.某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔
题目详情
氮及氮的化合物在化工研究中是一门重要的课题.
I.某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔绝空气加热可得到12.8gB和气体单质C.请回答:
(1)写出SCl2与氨反应的化学方程式___.
II.已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
(2)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),简述该设想能否实现的依据:___.
(3)汽车尾气转化器中发生的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=___.
(4)有容积相同的甲、乙两个密闭容器,甲充入等量的NO和CO气体,乙充入NO气体.
以Ag-ZSM-5为催化剂,分别在不同温度下同时发生反应,测得相同时间内NO的转化率,绘得图象如图1.
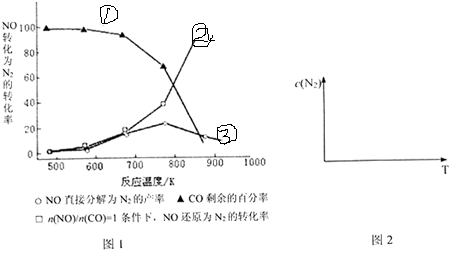 分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
(5)已知常温下HNO2的电离常数K=4.6×10-4,求0.01mol•L-1的HNO2溶液中c(H+)=___mol•L-1.(
=2.14)
I.某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔绝空气加热可得到12.8gB和气体单质C.请回答:
(1)写出SCl2与氨反应的化学方程式___.
II.已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
(2)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),简述该设想能否实现的依据:___.
(3)汽车尾气转化器中发生的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=___.
(4)有容积相同的甲、乙两个密闭容器,甲充入等量的NO和CO气体,乙充入NO气体.
以Ag-ZSM-5为催化剂,分别在不同温度下同时发生反应,测得相同时间内NO的转化率,绘得图象如图1.
 分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因___.在图2中画出反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.(5)已知常温下HNO2的电离常数K=4.6×10-4,求0.01mol•L-1的HNO2溶液中c(H+)=___mol•L-1.(
| | 4.6 |
▼优质解答
答案和解析
(1)因为“SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7、A隔绝空气加强热可得到 B和气体单质C”知B是S,A含N、S元素,C是氮气,X是氯化铵.n(A)=
=0.1mol,n(S)=
=0.4mol,则A中含N:
=0.4mol,故A的分子式为S4N4,所以SCl2与氨反应生成A和淡黄色单质B及离子化合物X,反应方程式:6SCl2+16NH3=S4N4+2S+12NH4Cl,
故答案为:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(2)因为C不完全燃烧时产生CO为放热反应,则2CO(g)=2C(s)+O2(g)△H>0,又熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;故答案为:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
(3)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律③×2-①-②得2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-393.5×2-180.5+221.0=-746.5kJ•mol-1,故答案为:-746.5kJ•mol-1;
(4)根据(3)2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以NO的转化率应该减小,而曲线②NO转化率随温度升高而增大说明反应没有达到平衡,温度越高反应速率越快,转化率越大;
又2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以温度越高,平衡时c(N2)越小,则变化趋势图为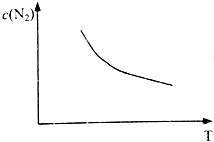 ,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大;
,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大; .
.
(5)因为HNO2的电离方程式为HNO2⇌H++NO2-,又电离常数K=4.6×10-4,所以K=
=
=4.6×10-4,解得:c(H+)=2.14×10-3mol•L-1,故答案为:2.14×10-3.
| 18.4g |
| 184g/mol |
| 12.8g |
| 32g/mol |
| (18.4-0.4×32)g |
| 14g/mol |
故答案为:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(2)因为C不完全燃烧时产生CO为放热反应,则2CO(g)=2C(s)+O2(g)△H>0,又熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;故答案为:不可行,因为△H>0,△S<0,在任何情况下都不能自发进行;
(3)①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
根据盖斯定律③×2-①-②得2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-393.5×2-180.5+221.0=-746.5kJ•mol-1,故答案为:-746.5kJ•mol-1;
(4)根据(3)2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以NO的转化率应该减小,而曲线②NO转化率随温度升高而增大说明反应没有达到平衡,温度越高反应速率越快,转化率越大;
又2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-746.5kJ•mol-1,则升高温度,平衡向逆反应方向移动,所以温度越高,平衡时c(N2)越小,则变化趋势图为
 ,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大;
,故答案为:反应没有达到平衡,温度越高反应速率越快,转化率越大; .
.(5)因为HNO2的电离方程式为HNO2⇌H++NO2-,又电离常数K=4.6×10-4,所以K=
| c(H +)c(NO 2 -) |
| c(HNO 2) |
| c 2(H +) |
| 0.01mol/L |
看了 氮及氮的化合物在化工研究中是...的网友还看了以下:
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究.(1)三氮化铵水解可生成氨气和 2020-05-13 …
农作物生长发育需要大量的氮养分,除了可用人工固氮方法(合成氨)获得氨态氮外,自然界雷电现象也是一种 2020-05-14 …
农作物生长发育需要大量的氮养分,除了可用人工固氮方法(合成氨)获得氨态氮外,自然界雷电现象也是一种 2020-05-14 …
同温同压下,1体积氮气和3体积氢气化合生成2体积氨气.已知氮气和氢气都由最简单分子构成,推断它们都 2020-05-15 …
求水质监测中测量总氮总磷取样量的问题最近在做水质检测的标准曲线,遇到一个问题是:利用做好的曲线如何 2020-06-25 …
下列变化不属于氮的固定的是()A.根瘤菌把氮气转化为氨B.氮气和氢气在适宜条件下合成氨C.氮气和氧 2020-07-02 …
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。(1)已知:H-H键能为436k 2020-07-20 …
氨气是一种重要的化工原料,氨态氮肥是常用的肥料.工业合成氨的化学方程式:N2+3H2催化剂高温高压 2020-07-22 …
一定温度下在一个体积可变的密闭容器中加入2摩尔氮气和2摩尔氢气,建立平衡.相同条件下,若向容器中再 2020-07-22 …
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.(1)298.15K时,N2、H2 2020-11-20 …