早教吧作业答案频道 -->化学-->
氮有不同价态的氧化物,如NO、N2O3、NO2、N2O5等,它们在一定条件下可以相互转化.(1)己知:2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-14NO2(g
题目详情
氮有不同价态的氧化物,如NO、N2O3、NO2、N2O5等,它们在一定条件下可以相互转化.
(1)己知:2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
则反应6NO2 (g)+O3(g)═3N2O5(g)△H=___.
(2)某温度下,在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3(g)⇌NO2(g)+NO(g)
达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图1所示,有关说法正确的是___
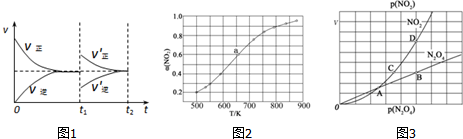
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容器的一半,则速率~时间图象与上图相同
(3)在1000K下,在某恒容容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图2所示.图中a点对应温度下,已知NO2的起始压强p0为120kPa,列式计算该温度下反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2).其中,kl、k2是与反应及温度有关的常数.相应的速率~压强关系如图3所示.一定温度下,kl、k2与平衡常数Kp的关系是kl=___,在如图标出的点中,指出能表示反应达到平衡状态的点___,理由是___.
(1)己知:2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
则反应6NO2 (g)+O3(g)═3N2O5(g)△H=___.
(2)某温度下,在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3(g)⇌NO2(g)+NO(g)
达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图1所示,有关说法正确的是___

A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容器的一半,则速率~时间图象与上图相同
(3)在1000K下,在某恒容容器中发生下列反应:2NO2(g)⇌2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图2所示.图中a点对应温度下,已知NO2的起始压强p0为120kPa,列式计算该温度下反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(4)对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2).其中,kl、k2是与反应及温度有关的常数.相应的速率~压强关系如图3所示.一定温度下,kl、k2与平衡常数Kp的关系是kl=___,在如图标出的点中,指出能表示反应达到平衡状态的点___,理由是___.
▼优质解答
答案和解析
(1)①2NO(g)+O2(g)═2NO2(g)△H1=-113kJ•mol-1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
③4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
将方程式②+③×
-①×
得6NO2 (g)+O3(g)═3N2O5(g),△H=-199kJ•mol-1-57kJ•mol-1×
+113kJ•mol-1×
=-228kJ•mol-1,
故答案为:-228kJ•mol-1;
(2)由速率与时间的变化图象可知,t1时刻改变某一条件后,反应N2O3(g)⇌NO2(g)+NO(g)正反应速率增大,逆反应速率减小,则改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度,
A.t1时刻改变的条件是增大N2O3的浓度,正反应速率增大,同时减小NO2或NO的浓度,逆反应速率减小,故A正确;
B.t1时刻改变条件后,增大N2O3的浓度,同时减小NO2或NO的浓度,虽然平衡向正反应方向移动,但N2O3的转化率仍减小,故B错误;
C.t1时刻改变条件后,增大N2O3的浓度,同时减小NO2或NO的浓度,平衡向正反应方向移动,则在t2时刻达到新的平衡后,NO2的百分含量增大,故C错误;
D.若t1时刻将容器的体积缩小至原容器的一半,则压强增大,正逆反应速率都增大,所以速率~时间图象与上图不同,故D错误;
故选:A;
(3)图中a点对应温度下,NO2的转化率是0.6,设原来NO2的物质的量为xmol,转化的物质的量为0.6xmol,
2NO2(g)⇌2NO(g)+O2(g),
开始 x 0 0
转化0.6xmol 0.6xmol 0.3xmol
平衡0.4xmol 0.6xmol 0.3xmol
则混合气体的物质的量=0.4xmol+0.6xmol+0.3xmol=1.3xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=
×1.3xmol=156KPa,NO2的分压=156KPa×
=48KPa,
NO的分压=156KPa×
=72KPa,
O2的分压=156KPa×
=36KPa
化学平衡常数Kp=
=
=81,
故答案为:81;
(4)反应N2O4(g)⇌2NO2(g),则化学平衡常数Kp=
,二者的反应速率之比等于其计量数之比,
则υ(NO2):υ(N2O4)=k2•p2(NO2):k1•p(N2O4)=2:1,又化学平衡常数Kp=
,
所以K1=
K2•Kp,
满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点,
故答案为:
K2•Kp;B点与D点;满足平衡条件υ(NO2)=2υ(N2O4).
②NO(g)+O3(g)═NO2(g)+O2(g)△H2=-199kJ•mol-1
③4NO2(g)+O2(g)═2N2O5(g)△H4=-57kJ•mol-1
将方程式②+③×
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:-228kJ•mol-1;
(2)由速率与时间的变化图象可知,t1时刻改变某一条件后,反应N2O3(g)⇌NO2(g)+NO(g)正反应速率增大,逆反应速率减小,则改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度,
A.t1时刻改变的条件是增大N2O3的浓度,正反应速率增大,同时减小NO2或NO的浓度,逆反应速率减小,故A正确;
B.t1时刻改变条件后,增大N2O3的浓度,同时减小NO2或NO的浓度,虽然平衡向正反应方向移动,但N2O3的转化率仍减小,故B错误;
C.t1时刻改变条件后,增大N2O3的浓度,同时减小NO2或NO的浓度,平衡向正反应方向移动,则在t2时刻达到新的平衡后,NO2的百分含量增大,故C错误;
D.若t1时刻将容器的体积缩小至原容器的一半,则压强增大,正逆反应速率都增大,所以速率~时间图象与上图不同,故D错误;
故选:A;
(3)图中a点对应温度下,NO2的转化率是0.6,设原来NO2的物质的量为xmol,转化的物质的量为0.6xmol,
2NO2(g)⇌2NO(g)+O2(g),
开始 x 0 0
转化0.6xmol 0.6xmol 0.3xmol
平衡0.4xmol 0.6xmol 0.3xmol
则混合气体的物质的量=0.4xmol+0.6xmol+0.3xmol=1.3xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=
| 120kPa |
| xmol |
| 0.4xmol |
| 1.3xmol |
NO的分压=156KPa×
| 0.6xmol |
| 1.3xmol |
O2的分压=156KPa×
| 0.3xmol |
| 1.3xmol |
化学平衡常数Kp=
| p(O 2)p(NO) 2 |
| p(NO 2) 2 |
| 36×72 2 |
| 48 2 |
故答案为:81;
(4)反应N2O4(g)⇌2NO2(g),则化学平衡常数Kp=
| [p(NO 2)] 2 |
| p(N 2O 4) |
则υ(NO2):υ(N2O4)=k2•p2(NO2):k1•p(N2O4)=2:1,又化学平衡常数Kp=
| [p(NO 2)] 2 |
| p(N 2O 4) |
所以K1=
| 1 |
| 2 |
满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点,
故答案为:
| 1 |
| 2 |
看了 氮有不同价态的氧化物,如NO...的网友还看了以下:
英语翻译G:Howdoyouspendyoursparetime,John?J:WatchingT 2020-05-13 …
MATLAB 如何赋值 画实部虚部图像 画图clearclcsyms a j k n u e A 2020-05-16 …
Fori=1To10f=TrueForj=1To9Ifa(j)>a(j+1)Thent=a(j)a 2020-05-23 …
将2.0kg的物体从静止开始,以1.0m/s2的加速度竖直提升8.0m,需要做的功为J,物体的重力 2020-06-05 …
下列词语中加点字的读音,有一处错误的一组是()A.果脯(pǔ)中(zhòng)肯同胞(bāo)枸杞 2020-07-13 …
关于一个极限的数学公式当limf(x)^g(x)=e^j,为什么其中J=limg(x)[f(x)- 2020-07-20 …
用50N的力拉一个质量为10kg的物体在水平地面上前进,拉力与水平方向的夹角为37°.若物体前进了1 2020-10-31 …
我现在有如下公式,目前还想实现如果G列等于“标”,“协A”,“协B”,“成交”等的话就为空白,超层数 2020-10-31 …
下列常用词语中字音有错误的一组是A.粗犷guǎng皈依guī瑰丽guī狼藉jíB.一触即发jí脊梁j 2020-12-02 …
选出下面各项中字音有误的一项:A成绩斐然fěi孵化fū惊魂甫定fǔ作茧自缚fùB言简意赅gāi罡风g 2020-12-23 …