早教吧作业答案频道 -->化学-->
请回答:(1)羰基硫(COS)的电子式为:.(2)已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ.写出N4(形似白磷)气体转变为N2的热化学方程式:.(3)向FeCl3和BaCl2的酸性混合溶
题目详情
请回答:
(1)羰基硫(COS)的电子式为:___.
(2)已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ.写出N4(形似白磷)气体转变为N2的热化学方程式:___.
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是___.
(4)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量___.(填“相同”,“不同”或“无法判断”)
(1)羰基硫(COS)的电子式为:___.
(2)已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ.写出N4(形似白磷)气体转变为N2的热化学方程式:___.
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是___.
(4)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量___.(填“相同”,“不同”或“无法判断”)
▼优质解答
答案和解析
(1)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为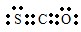 ,
,
故答案为: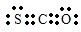 ;
;
(2)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,N4气体转变为N2的热化学方程式为:N4(g)⇌2N2(g) △H=-882KJ/mol,
故答案为:N4(g)⇌2N2(g) △H=-882KJ/mol;
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,
发生2Fe3++SO2+2H2O═SO42-+4H++2Fe2+,
SO42-+Ba2+═BaSO4↓,
故答案为:BaSO4;
(4)Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同,
故答案为:相同.
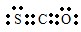 ,
,故答案为:
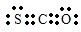 ;
;(2)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,N4气体转变为N2的热化学方程式为:N4(g)⇌2N2(g) △H=-882KJ/mol,
故答案为:N4(g)⇌2N2(g) △H=-882KJ/mol;
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,
发生2Fe3++SO2+2H2O═SO42-+4H++2Fe2+,
SO42-+Ba2+═BaSO4↓,
故答案为:BaSO4;
(4)Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同,
故答案为:相同.
看了 请回答:(1)羰基硫(COS...的网友还看了以下:
当细菌繁殖时,一个细菌分裂成两个,一个细菌在分裂t次后,数量为2的t次方个…当细菌繁殖时,一个细菌 2020-05-17 …
当细菌繁殖时,一个细菌分裂成两个,一个细菌在分裂n次后,数量为2^n个.甲是一种分裂很快的细菌,它 2020-06-20 …
石油裂化主要产物是什么?只有一个空高质量的是裂化不是裂解好不好。题都不看另外请具体一些烯烃太含糊了 2020-07-13 …
已知一定条件下断裂或生成某些化学键的能量关系如下表:断裂或生成的化学键能量数据断裂1molH2分子 2020-07-19 …
已知一定条件下断裂或生成某些化学键的能量关系如下表:断裂或生成的化学键能量数据断裂1molH2分子 2020-07-19 …
已知一定条件下断裂或生成某些化学键的能量关系如下表:断裂或生成的化学键能量数据断裂1molH2分子 2020-07-19 …
在25℃、101kPa的条件下,断裂1molH-H键吸收436kJ能量,断裂1molCl-Cl键吸 2020-07-22 …
下列为二倍体雄性动物细胞分裂的几种模式图及其每条染色体的DNA含量在分裂过程中的变化.请据图分析回答 2020-11-02 …
设某动物的一个体细胞中核DNA含量为2个单位(2C).(1)请绘出该动物的初级精母细胞减数分裂过程中 2020-11-10 …
斜抛射运动,途中爆裂的问题1)质量为4kg之炮弹以10m/s,60度仰角抛出,途中爆裂为质量比2:1 2020-12-05 …