早教吧作业答案频道 -->化学-->
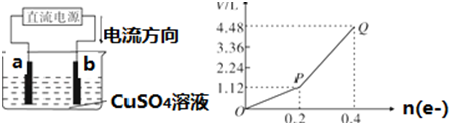
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体
题目详情
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).
(1)b电极名称___电解过程中,a电极表面的现象是___
(2)a电极上发生的反应为___
(3)从P点到Q点时收集到的气体成分___,混合气体的平均摩尔质量为___g•mol-1
(4)①如果向所得的溶液中加入0.8g CuO后,使溶液恰好恢复到电解前的浓度,则电解后溶液的pH为___ (忽略溶液体积的变化)
②如果向所得的溶液中加入0.1mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度(不考虑CO2的溶解),电解过程中转移的电子为___mol.
(1)b电极名称___电解过程中,a电极表面的现象是___
(2)a电极上发生的反应为___
(3)从P点到Q点时收集到的气体成分___,混合气体的平均摩尔质量为___g•mol-1
(4)①如果向所得的溶液中加入0.8g CuO后,使溶液恰好恢复到电解前的浓度,则电解后溶液的pH为___ (忽略溶液体积的变化)
②如果向所得的溶液中加入0.1mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度(不考虑CO2的溶解),电解过程中转移的电子为___mol.

▼优质解答
答案和解析
(1)由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O
2H2↑+O2↑,a为阴极,先发生Cu2++2e-=Cu,后发生2H++2e-=H2↑,电极表面的现象是红色固体物质析出,电解一段时间后放出气体,故答案为:阳极;红色固体物质析出,电解一段时间后放出气体;
(2)a为阴极,先发生Cu2++2e-=Cu,后发生2H++2e-=H2↑,故答案为:Cu2++2e-=Cu,2H++2e-=H2↑;
(3)到Q点时收集到的混合气体为氢气和氧气,由电解水反应可知0.2mol电子通过时生成0.1molH2、0.05molO2,则混合气体的平均摩尔质量为
g/mol=12g•mol-1,故答案为:12;
(4)①由信息可知,电解发生2H2O+2CuSO4
2Cu+O2↑+2H2SO4 ,向所得溶液中加入0.8g即
=0.01mol CuO充分反应后,溶液恰好恢复到电解前的状态,则电解中生成0.01molCu,同时生成0.01molH2SO4,所以电解后溶液的C(H+)=
=0.1mol/L,pH=1.
故答案为:1;
②电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O
2Cu+O2↑+2H2SO4,
第二阶段:2H2O
2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,
第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.2mol,转移电子的物质的量=0.2mol×2=0.4mol;
第二阶段:电解生成0.1mol水转移电子的物质的量=0.1mol×2=0.2mol,
所以电解过程中共转移的电子数为0.4mol+0.2mol=0.6mol,故答案为:0.6.
| ||
| ||
(2)a为阴极,先发生Cu2++2e-=Cu,后发生2H++2e-=H2↑,故答案为:Cu2++2e-=Cu,2H++2e-=H2↑;
(3)到Q点时收集到的混合气体为氢气和氧气,由电解水反应可知0.2mol电子通过时生成0.1molH2、0.05molO2,则混合气体的平均摩尔质量为
| 0.1×2+0.05×32 |
| 0.1+0.05 |
(4)①由信息可知,电解发生2H2O+2CuSO4
| ||
| 0.8g |
| 80g/mol |
| 0.01×2mol |
| 0.2L |
故答案为:1;
②电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O
| ||
第二阶段:2H2O
| ||
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,
第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.2mol,转移电子的物质的量=0.2mol×2=0.4mol;
第二阶段:电解生成0.1mol水转移电子的物质的量=0.1mol×2=0.2mol,
所以电解过程中共转移的电子数为0.4mol+0.2mol=0.6mol,故答案为:0.6.
看了 用惰性电极电解200mL一定...的网友还看了以下:
常温下用石墨作电极,电解100ml0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液 2020-05-14 …
常温下用石墨作电极,电解100ml0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液 2020-05-14 …
将0.3mol硝酸银、0.6mol硝酸铜、0.7mol氯化钾溶于水,配成100mL溶液,用惰性电极 2020-05-14 …
无水碳酸钠标定盐酸计算公式我用无水碳酸钠0.0762g标定0.1mol/L盐酸消耗盐酸14.08m 2020-05-16 …
有一可进行电池反应的两个半反应,电极和电解质溶液的物质均相同,但溶液的浓度不同,其电池的电动势() 2020-07-01 …
将含有0.4mol硝酸铜和0.4mol氯化钾的水溶液1L,用惰性电极电解一段时间后,在一个电极上析 2020-07-03 …
高锰酸钾标准滴定溶液c(1/5KMnO4)=0.01mol/L和草酸标准滴定溶液c(1/2H2C2 2020-07-09 …
如何由25℃的标准电极电势和温度系数求其它温度下的电极电势?25℃时Zn离子/Zn电极的标准电极电 2020-07-15 …
什么是电池的“比能量”“比功率”?磷酸铁锂电池指标如何?铅酸电池,镍氢电池,磷酸铁锂电池,锌空气电 2020-07-29 …
重铬酸钾及EDTA标液的配制1:做全铁和亚铁分析需要用到0.0512mol/l的重铬酸钾标液,重铬酸 2020-11-07 …