早教吧作业答案频道 -->化学-->
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.Ⅰ.结晶水的测定:称取7.84g浅蓝绿晶体,加热至1
题目详情
某 小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
Ⅰ.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温后,称重,质量为5.68g.
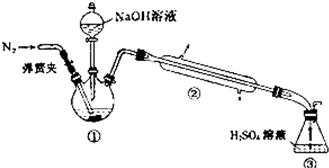
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入氮气,用40.00mL 1mol•L-1的硫酸溶液吸收产生氨气.蒸氨结束后取下接收瓶,用2mol•L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液.
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的物质全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6g.回答下列问题:
(1)在实验I中,不可能用到的实验仪器是___(填正确答案标号)
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是___.
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用___式滴定管;可使用的指示剂为___;若在滴加氢氧化钠溶液时有少量待测液溅出,会使测量值___.
(4)在实验中,检验沉淀是否洗净的方法是___
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为___,三颈瓶中发生反应的离子方程式为___.

Ⅰ.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温后,称重,质量为5.68g.
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入氮气,用40.00mL 1mol•L-1的硫酸溶液吸收产生氨气.蒸氨结束后取下接收瓶,用2mol•L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液.
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的物质全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6g.回答下列问题:
(1)在实验I中,不可能用到的实验仪器是___(填正确答案标号)
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是___.
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用___式滴定管;可使用的指示剂为___;若在滴加氢氧化钠溶液时有少量待测液溅出,会使测量值___.
(4)在实验中,检验沉淀是否洗净的方法是___
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为___,三颈瓶中发生反应的离子方程式为___.
▼优质解答
答案和解析
(1)结晶水的测定:称量需要托盘天平(G),加热需要酒精灯(E)、坩埚(C)、铁架台带铁圈(B)、玻璃棒、干燥时需干燥器(F)等,无须用烧杯(A)、蒸发皿(D),
故答案为:AD;
(2)实验Ⅱ的目的是测定铵根离子的含量,通过铵根离子和碱反应生成的氨气的量测定,NH4++OH-
NH3↑+H2O,根据将氨气全部赶出,减小误差需通入氮气,
故答案为:将溶液中的氨全部蒸出;
(3)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中,所以用NaOH标准溶液确定过剩的H2SO4时,应使用碱式滴定管盛放NaOH溶液;NaOH溶液和硫酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂,甲基红为酸性变色指示剂、酚酞为碱性变色指示剂,所以可以选取甲基红或酚酞作指示剂,若在滴加氢氧化钠溶液时有少量待测液溅出,则测得的过剩的硫酸偏少,即消耗的硫酸偏大,则测定的结果会偏大,
故答案为:碱;酚酞(或甲基红);偏大;
(4)溶液中存在硫酸铵,若未洗净,加入1-2滴稀硝酸,再滴入硝酸钡溶液,有白色沉淀生成,所以检验沉淀是否洗净的方法是:取最后一次洗涤液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净,
故答案为:取最后一次洗涤液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净;
(5)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g-5.68g=2.16g,n(H2O)=
=0.12mol,
消耗氢氧化钠的物质的量是n=cv=lmol•L-1×40.00mL=0.04mol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知:剩余硫酸的物质的量是2mol•L-1×20.00mL×
=0.02mol,则根据反应式2NH3+H2SO4=(NH4)2SO4可知:与氨气反应的硫酸的物质的量是0.04mol-0.02mol=0.02mol,则与硫酸反应的氨气的物质的量是0.02mol×2=0.04mol,生成的m(NH3)=0.68g,2Fe2++H2O2+2H+=2Fe3++2H2O,测得其质量为1.6g为氧化铁,m(Fe2O3)=1.6g,n(Fe2O3)=
=0.01mol,则m(NH4+)=0.04mol×18g/mol=0.72g,m(Fe2+)=0.02mol×56g/mol=1.12g,则m(SO42-)=7.84g-2.16g-0.72g-1.12g=3.84g,n(SO42-)=
=0.04mol,所以n(NH4+):n(Fe2+):n((SO42-):n(H2O)=0.04mol:0.02mol:0.04mol:0.12mol=2:1:2:6,该浅蓝绿晶体的化学式为FeSO4•(NH4)2 SO4•6H2O 或(NH4)2Fe(SO4)2•6H2O,三颈瓶中亚铁离子和铵根离子和氢氧根反应生成氢氧化亚铁,反应为:2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O,
故答案为:FeSO4•(NH4)2 SO4•6H2O 或(NH4)2Fe(SO4)2•6H2O;2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O.
故答案为:AD;
(2)实验Ⅱ的目的是测定铵根离子的含量,通过铵根离子和碱反应生成的氨气的量测定,NH4++OH-
| ||
故答案为:将溶液中的氨全部蒸出;
(3)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中,所以用NaOH标准溶液确定过剩的H2SO4时,应使用碱式滴定管盛放NaOH溶液;NaOH溶液和硫酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂,甲基红为酸性变色指示剂、酚酞为碱性变色指示剂,所以可以选取甲基红或酚酞作指示剂,若在滴加氢氧化钠溶液时有少量待测液溅出,则测得的过剩的硫酸偏少,即消耗的硫酸偏大,则测定的结果会偏大,
故答案为:碱;酚酞(或甲基红);偏大;
(4)溶液中存在硫酸铵,若未洗净,加入1-2滴稀硝酸,再滴入硝酸钡溶液,有白色沉淀生成,所以检验沉淀是否洗净的方法是:取最后一次洗涤液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净,
故答案为:取最后一次洗涤液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净;
(5)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g-5.68g=2.16g,n(H2O)=
| 2.16g |
| 18g/mol |
消耗氢氧化钠的物质的量是n=cv=lmol•L-1×40.00mL=0.04mol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知:剩余硫酸的物质的量是2mol•L-1×20.00mL×
| 1 |
| 2 |
| 1.6g |
| 160g/mol |
| 3.84g |
| 96g/mol |
故答案为:FeSO4•(NH4)2 SO4•6H2O 或(NH4)2Fe(SO4)2•6H2O;2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O.
看了 某小组以废铁屑、稀硫酸、饱和...的网友还看了以下:
松香,明矾,冰,玻璃,铁,塑料,橡胶,蜂蜡,水晶,硫代硫酸钠中,属于晶体的是,()他们有一定的熔化 2020-05-16 …
实验室测定某黄铜屑(由锌和铜形成的合金)的组成,分四次取样品与稀硫酸反应,其实验数据记录如下表.1 2020-05-17 …
硫酸铜与明矾一起结晶硫酸铜和明矾一起结晶,会得到硫酸铜和明矾的混合物吗?是什么色的?(硫酸铜是五水 2020-05-22 …
某同学在配制硫酸铜溶液时,用电子分析天平称取硫酸铜晶体,用量筒取水配成溶液,此操作对否?为什么? 2020-06-26 …
从溶液中取出硫酸铜晶核的方法使用镊子一个一个的全部取出但取出后镊子上的晶核放在那里?脱脂棉还是其它 2020-06-26 …
烧杯中的溶液经处理得硫酸亚铁晶体.准确称取晶体0.5000g置于锥形瓶中,加入10ml3mol/L 2020-06-26 …
一道关于硫酸的计算题很急很急得呀.1称取10g硫酸铵样品配成100ml溶液,取出20ml,加入过量的 2020-11-03 …
实验室制取稀硫酸为什么不直接稀释浓硫酸为什么要用亚硫酸钠和浓硫酸反应,生成二氧化硫,然后再制取硫酸 2021-02-01 …
某硫酸亚铁晶体热分解研究,该兴趣小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得 2021-02-01 …
现有一瓶浓硫酸标签如下:硫酸(500ml)化学式H2S04密度:1.84g/cm立方质量分数:98% 2021-02-18 …