早教吧作业答案频道 -->化学-->
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量.Ⅰ.CO2加氢合成甲醇是合理利用CO2的有效途径.由CO2制备甲醇过程可能涉及反应如下:反应①:CO2(g
题目详情
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量.
Ⅰ.CO2加氢合成甲醇是合理利用 CO2的有效途径.由 CO2制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应②:CO2(g)+H2(g)⇌CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)⇌CH3OH(g)△H3=-90.77kJ•mol-1,回答下列问题:
(1)反应②的△H2=___,反应 ①自发进行条件是___(填“较低温”、“较高温”或“任何温度”).
(2)某温度下,在体积为2L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①.一段时间后达到平衡.
测得甲中CO2和CH3OH(g)的浓度随时间变化如图所示.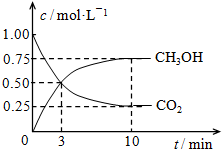
①前3min内,平均反应速率v(H2)=___mol•L-1•min-1.此温度下该反应的平衡常数为
___(结果保留两位小数).
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是___.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离
D.再充入1mol H2 E.再充入1mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡___(填“正向”、“逆向”或“不”)移动.
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为___.
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4).氨基甲酸铵极易发生:H2NCOONH4+2H2O⇌NH4HCO3+NH3•H2O,该反应酸性条件下更彻底.25℃,向l L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵.若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=___,NH4+水解常数Kh=___.
Ⅰ.CO2加氢合成甲醇是合理利用 CO2的有效途径.由 CO2制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应②:CO2(g)+H2(g)⇌CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)⇌CH3OH(g)△H3=-90.77kJ•mol-1,回答下列问题:
(1)反应②的△H2=___,反应 ①自发进行条件是___(填“较低温”、“较高温”或“任何温度”).
(2)某温度下,在体积为2L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①.一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |

①前3min内,平均反应速率v(H2)=___mol•L-1•min-1.此温度下该反应的平衡常数为
___(结果保留两位小数).
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是___.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离
D.再充入1mol H2 E.再充入1mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡___(填“正向”、“逆向”或“不”)移动.
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为___.
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4).氨基甲酸铵极易发生:H2NCOONH4+2H2O⇌NH4HCO3+NH3•H2O,该反应酸性条件下更彻底.25℃,向l L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵.若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=___,NH4+水解常数Kh=___.
▼优质解答
答案和解析
(1)反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)⇌CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)⇌CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1;根据反应自发行的判据:△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行,
故答案为:+41.19 kJ•mol-1;较低温;
(2)①前3min内,平均反应速率v(CO2)=
mol/(L.min)=
mol/(L.min);
平均反应速率v(H2)=3v(CO2)=
mol/(L.min)×3=0.5mol/(Lmin);
平衡时,c(CO2)=0.25mol/L、c(CH3OH)=c(H2O)=0.75mol/L、c(H2)=3mol/L-0.75mol/L×3=0.75mol/L,
化学平衡常数K=
=
=5.33,
故答案为:0.5;5.33;
②A.升高温度增大反应速率,但平衡逆向移动,则n(CH3OH)/n(CO2)减小,故错误;
B.充入惰性气体,反应物和生成物浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,反应速率不变,故错误;
C.将H2O(g)从体系中分离,平衡正向移动,但反应速率减小,故错误;
D.再充入1mol H2 ,平衡正向移动,二氧化碳的物质的量减小、甲醇的物质的量增大,反应速率增大且n(CH3OH)/n(CO2)增大,故正确;
E.再充入1mol CO2,平衡正向移动,但n(CH3OH)/n(CO2)减小,故错误;
F.加入催化剂增大反应速率但平衡不移动,则n(CH3OH)/n(CO2)不变,故错误;
故选D;
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,
c(CO2)=0.25mol/L+0.5mol/L=0.75mol/L、c(CH3OH)=c(H2O)=0.75mol/L+0.5mol/L=1.25mol/L、c(H2)=3mol/L-0.75mol/L×3+0.5mol/L=1.25mol/L,
浓度商=
=1.1<5.33,平衡正向移动,
故答案为:正向;
④甲中反应达到平衡状态时n(CO2)=0.5mol、c(CH3OH)=c(H2O)=1.5mol、c(H2)=1.5mol,
如果乙中反应达到平衡状态时各物质与甲中相同,则a+c=2mol,且起始时维持化学反应向逆反应方向进行,b应该大于甲中转化的二氧化碳物质的量,属于c的取值范围为1.5 mol/L<c≤2 mol/L,
故答案为:1.5 mol/L<c≤2 mol/L;
(3)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O⇌(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
该反应NH4++H2O⇌NH3•H2O+H+;
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数Kh=
=
mol/L=4×10-9mol/L,
故答案为:0.1mol/L;4×10-9 mol/L.
反应Ⅱ:CO2(g)+H2(g)⇌CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)⇌CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1;根据反应自发行的判据:△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行,
故答案为:+41.19 kJ•mol-1;较低温;
(2)①前3min内,平均反应速率v(CO2)=
| 1.00-0.50 |
| 3 |
| 1 |
| 6 |
平均反应速率v(H2)=3v(CO2)=
| 1 |
| 6 |
平衡时,c(CO2)=0.25mol/L、c(CH3OH)=c(H2O)=0.75mol/L、c(H2)=3mol/L-0.75mol/L×3=0.75mol/L,
化学平衡常数K=
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
故答案为:0.5;5.33;
②A.升高温度增大反应速率,但平衡逆向移动,则n(CH3OH)/n(CO2)减小,故错误;
B.充入惰性气体,反应物和生成物浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,反应速率不变,故错误;
C.将H2O(g)从体系中分离,平衡正向移动,但反应速率减小,故错误;
D.再充入1mol H2 ,平衡正向移动,二氧化碳的物质的量减小、甲醇的物质的量增大,反应速率增大且n(CH3OH)/n(CO2)增大,故正确;
E.再充入1mol CO2,平衡正向移动,但n(CH3OH)/n(CO2)减小,故错误;
F.加入催化剂增大反应速率但平衡不移动,则n(CH3OH)/n(CO2)不变,故错误;
故选D;
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,
c(CO2)=0.25mol/L+0.5mol/L=0.75mol/L、c(CH3OH)=c(H2O)=0.75mol/L+0.5mol/L=1.25mol/L、c(H2)=3mol/L-0.75mol/L×3+0.5mol/L=1.25mol/L,
浓度商=
| 1.25×1.25 |
| 0.75×1.253 |
故答案为:正向;
④甲中反应达到平衡状态时n(CO2)=0.5mol、c(CH3OH)=c(H2O)=1.5mol、c(H2)=1.5mol,
如果乙中反应达到平衡状态时各物质与甲中相同,则a+c=2mol,且起始时维持化学反应向逆反应方向进行,b应该大于甲中转化的二氧化碳物质的量,属于c的取值范围为1.5 mol/L<c≤2 mol/L,
故答案为:1.5 mol/L<c≤2 mol/L;
(3)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O⇌(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
该反应NH4++H2O⇌NH3•H2O+H+;
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数Kh=
| c(NH3.H2O).c(H+) |
| c(NH4+) |
| 0.004×10-7 |
| 0.1 |
故答案为:0.1mol/L;4×10-9 mol/L.
看了 第21届联合国气候大会于20...的网友还看了以下:
有下列反应:①由乙醇制乙烯②甲烷在空气中燃烧③由乙炔制氯乙烯④丙烯使溴水褪色⑤苯与浓硝酸、浓硫酸的 2020-05-13 …
1,醇发生酯化反应2,酯发生水解生成醇的反应3,醇发生氧化反应生成醛4,醛发生还原反应生成醇 2020-05-13 …
1、乙醛与甲醇反应,生成的这个有机物叫什么?2、它们反应,甲醇到底如何断键?是断羟基上的氢氧键,然 2020-05-16 …
英语翻译1.孟子大醇,荀卿小疵2.并世无孔子,不当在弟子之列!这位仁兄虽诠释失当,然其勇气固可嘉也 2020-05-22 …
醇钠与卤化烃的反应甲醇钠,叔丁醇钠与1-溴丙烷的反应有是么区别?难道都是醚吗? 2020-06-28 …
关于醇与活泼金属反应乙醇和钠反应得乙醇钠和氢气R-OH与Mg反应书上写着是Mg(OR)2,为什么这 2020-07-05 …
无机化学问题甲醇可以通过反应CO(g)+2H2(g)=CH3OH(g)来合成,225℃时该反应的K 2020-07-19 …
甘露醇是临床上良好的利尿剂,能有效减轻水肿症状,某实验室给狗注射20%甘露醇浓溶液,尿量变化与下列哪 2020-11-24 …
10g某一元醇A和乙酸在一定条件下反应生成某酯17.6g,还回收到未反应的醇0.8g,则A为A.甲醇 2020-12-26 …
几个关于高中有机的问题1.醇的消去反应条件是什么?乙醇是浓硫酸170度,那其他的醇哪?2.三键双键断 2021-02-05 …