早教吧作业答案频道 -->化学-->
食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、7
题目详情
食盐是日常生活的必需品,也是重要的化工原料.
粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.实验室提纯NaCl的流程如图1:
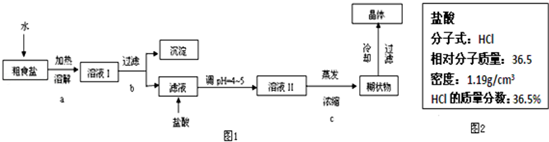
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,从实验室提供的试剂中选出,按滴加顺序依次为___
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:___;
加入试剂iii:___、___.
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为___.(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如图2:
欲用图2所述的浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、___、___(填仪器名称)
②需量取的浓盐酸的体积为:___.
粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.实验室提纯NaCl的流程如图1:

(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,从实验室提供的试剂中选出,按滴加顺序依次为___
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:___;
加入试剂iii:___、___.
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为___.(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如图2:
欲用图2所述的浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、___、___(填仪器名称)
②需量取的浓盐酸的体积为:___.
▼优质解答
答案和解析
在溶液Ⅰ中可依次加入氢氧化钠、氯化钡、饱和碳酸钠溶液,过滤所得滤液含有氯化钠、氢氧化钠和碳酸钠,加入盐酸,所得溶液Ⅱ为氯化钠,蒸发浓缩,冷却结晶可得到氯化钠晶体.
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,应首先加入过量的氢氧化钠除去镁离子和三价铁离子,然后加入过量的氯化钡可以除去硫酸根离子,最后加入过量的饱和碳酸钠溶液除去过量的钡离子和钙离子,
故答案为:NaOH溶液,BaCl2溶液,饱和Na2CO3溶液;
(2)加入氢氧化钠后氢氧根离子与镁离子反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
加入碳酸钠后,钙离子与碳酸根离子反应生成碳酸钙沉淀,离子方程式为:Ba2++CO32-=BaCO3↓;
钡离子与碳酸根离子反应生成碳酸钡沉淀,离子方程式:Ca2++CO32-=CaCO3↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓;
(3)除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(4)①用浓溶液配制烯溶液的步骤为:计算出需要的浓盐酸的体积16.8ml,用20ml量筒量取所需要的浓盐酸的体积,在烧杯中稀释(可用量筒量取水),用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以还需要的玻璃仪器有:20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶;
故答案为:20mL量筒;500mL容量瓶;
②从浓盐酸试剂瓶上的有关数据可知盐酸的密度为1.19g/ml,质量分数为36.5%,摩尔质量为36.5g/mol,
依据C=
,该浓盐酸的物质的量浓度为:C=
mol/L=11.9mol/L,稀释前后溶液中所含的氯化氢的物质的量不变,设消耗浓盐酸的体积为Vml,则11.9mol/L×V=0.400mol/L×500ml,解得V=16.8ml,
故答案为:16.8mL.
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,应首先加入过量的氢氧化钠除去镁离子和三价铁离子,然后加入过量的氯化钡可以除去硫酸根离子,最后加入过量的饱和碳酸钠溶液除去过量的钡离子和钙离子,
故答案为:NaOH溶液,BaCl2溶液,饱和Na2CO3溶液;
(2)加入氢氧化钠后氢氧根离子与镁离子反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
加入碳酸钠后,钙离子与碳酸根离子反应生成碳酸钙沉淀,离子方程式为:Ba2++CO32-=BaCO3↓;
钡离子与碳酸根离子反应生成碳酸钡沉淀,离子方程式:Ca2++CO32-=CaCO3↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓;
(3)除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(4)①用浓溶液配制烯溶液的步骤为:计算出需要的浓盐酸的体积16.8ml,用20ml量筒量取所需要的浓盐酸的体积,在烧杯中稀释(可用量筒量取水),用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以还需要的玻璃仪器有:20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶;
故答案为:20mL量筒;500mL容量瓶;
②从浓盐酸试剂瓶上的有关数据可知盐酸的密度为1.19g/ml,质量分数为36.5%,摩尔质量为36.5g/mol,
依据C=
| 1000ρw |
| M |
| 1000×1.19×36.5% |
| 36.5 |
故答案为:16.8mL.
看了 食盐是日常生活的必需品,也是...的网友还看了以下:
某课题组进行实验研究时,欲配制浓度均为1.0mol•L-1的Ba(OH)2和H2SO4溶液.Ⅰ.该 2020-05-14 …
一定温度下,一定质量的BA(OH)2饱和溶液加入少量固体BaO,恢复原温度后Ba离子总数为何会减少 2020-05-23 …
1938年哈恩用中子轰击铀核,发现产物中有原子核钡(Ba)、氪(Kr)、中子和一些γ射线.下列关于 2020-07-01 …
如图为内燃机中的连杆传动装置部分示意图.当气缸中高压气体以力F推活塞时,某时刻连杆BA与BO的夹角 2020-07-19 …
为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中 2020-07-20 …
根据下列实验操作和现象所得到的结论正确的是()选项实验操作和现象结论A向某食盐溶液中滴加淀粉溶液, 2020-07-22 …
下列是学生设计验证铁与锌金属活动性强弱的实验装置图,通过实验现象就能判断出金属活动性的强弱,四组实验 2020-11-01 …
检验某未知溶液中是否含有SO42-,下列操作最合理的是()A.加入稀硝酸酸化的Ba(NO3)2溶液B 2020-11-21 …
1.已知钡(Ba)是一种非常活泼的金属,遇到水会发生剧烈反应,放出氢气,反应的化学方程式为Ba+2H 2020-12-07 …
检验某未知溶液中是否含有SO2-4的下列操作中最合理的是()A.加入硝酸酸化的Ba(NO3)2B.先 2020-12-09 …