早教吧作业答案频道 -->化学-->
二氯亚砜(SOCl2)是一种无色易挥发液体,熔点-105℃,沸点79℃,140℃以上易分解,遇水剧烈反应生成SO2与HCl,常用作脱水剂.(1)SOCl2遇水发生反应的化学方程式.(2)甲同学用下图装
题目详情
二氯亚砜(SOCl2)是一种无色易挥发液体,熔点-105℃,沸点79℃,140℃以上易分解,遇水剧烈反应生成SO2与HCl,常用作脱水剂.
(1)SOCl2遇水发生反应的化学方程式___.
(2)甲同学用下图装置制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
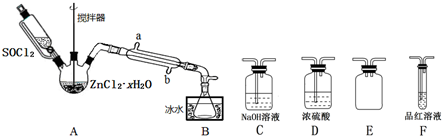
①装置的连接顺序为A→B→___→___→___→___.
②搅拌的作用是___,适合A的加热方式是___,冷凝管的进水口是___.(填“a”或“b”)
③一段时间后,F中观察到的现象是___,C中新增的阴离子可能有___.
④实验结束后,为检测ZnCl2•xH2O是否完全脱水,称取蒸干后的固体a g溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg,若
=___(保留一位小数),即可证明ZnCl2•xH2O已完全脱水.
⑤乙同学认为直接将ZnCl2•xH2O置于坩埚中加热即可得到无水ZnCl2,你认为这种方法是否可行,并说明原因:___.
(3)若用SOCl2作FeCl3•6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应.
实验方案如下:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;___.
(1)SOCl2遇水发生反应的化学方程式___.
(2)甲同学用下图装置制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):

①装置的连接顺序为A→B→___→___→___→___.
②搅拌的作用是___,适合A的加热方式是___,冷凝管的进水口是___.(填“a”或“b”)
③一段时间后,F中观察到的现象是___,C中新增的阴离子可能有___.
④实验结束后,为检测ZnCl2•xH2O是否完全脱水,称取蒸干后的固体a g溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg,若
| b |
| a |
⑤乙同学认为直接将ZnCl2•xH2O置于坩埚中加热即可得到无水ZnCl2,你认为这种方法是否可行,并说明原因:___.
(3)若用SOCl2作FeCl3•6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应.
实验方案如下:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;___.
▼优质解答
答案和解析
(1)SOCl2遇水剧烈反应生成SO2与HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→F→E→C,
故答案为:D,F,E,C;
②搅拌可以增大接触面积,加快脱水速率;温度过高SOCl2会分解,应采取水浴加热,受热均匀,便于控制温度;应整个冷凝管充满冷凝水,充分冷却,应从b口进水,
故答案为:增大接触面积,加快脱水速率;水浴加热;b;
③二氧化硫具有漂白性,一段时间,可以观察到F中品红溶液褪色,氢氧化钠溶液吸收二氧化硫、HCl,新增的阴离子可能有SO32-、Cl-、HSO3-,
故答案为:品红溶液褪色;SO32-、Cl-、HSO3-;
④ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒:
×2=
,整理可得
=2.1,
故答案为:2.1;
⑤ZnCl2加热时会水解为氢氧化锌与HCl,氢氧化锌受热分解为ZnO,不能得到ZnCl2,该方案不可行,
故答案为:不可行,因为ZnCl2加热时水解;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应方案为:
方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应,
故答案为:方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应.
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→F→E→C,
故答案为:D,F,E,C;
②搅拌可以增大接触面积,加快脱水速率;温度过高SOCl2会分解,应采取水浴加热,受热均匀,便于控制温度;应整个冷凝管充满冷凝水,充分冷却,应从b口进水,
故答案为:增大接触面积,加快脱水速率;水浴加热;b;
③二氧化硫具有漂白性,一段时间,可以观察到F中品红溶液褪色,氢氧化钠溶液吸收二氧化硫、HCl,新增的阴离子可能有SO32-、Cl-、HSO3-,
故答案为:品红溶液褪色;SO32-、Cl-、HSO3-;
④ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒:
| ag |
| 136g/mol |
| bg |
| 143.5g/mol |
| b |
| a |
故答案为:2.1;
⑤ZnCl2加热时会水解为氢氧化锌与HCl,氢氧化锌受热分解为ZnO,不能得到ZnCl2,该方案不可行,
故答案为:不可行,因为ZnCl2加热时水解;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应方案为:
方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应,
故答案为:方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应;
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应;
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应.
看了 二氯亚砜(SOCl2)是一种...的网友还看了以下:
以下说法中正确的是()①甲乙两物质的饱和溶液由t2℃降至t1℃时,都有晶体析出.已知此温度区间,S 2020-05-14 …
一道关于比热容的题目甲液体的质量是乙液体的4倍,乙的比热容是甲比热容德2倍,把乙投入甲热体中后,发 2020-05-14 …
如图所示,将甲乙两个容器放在水平桌面上,甲、乙两容器的底面积分别为S甲和S乙.甲容器中盛有密度为ρ 2020-05-20 …
两个底面积不同的圆柱形容器分别盛有不同的液体甲和乙(S甲>S乙),液体对容器底部的压强相等(h甲< 2020-06-06 …
水平放置的甲、乙两个圆柱形容器的底面积分别为S甲和S乙,分别装有质量相等的水和酒精,液面的高度分别 2020-06-20 …
甲乙两位同学沿长400米的环形跑道,同时出发,甲的速度为8m/s甲乙两位同学沿长400米的环形跑道 2020-07-19 …
两个底面积不等的圆柱形容器(S甲<S乙),分别盛有甲、乙两种不同的液体,将两个完全相同的小球分别放 2020-07-19 …
已知甲、乙两个薄壁圆柱形容器的底面积为S甲和S乙,且S甲<S乙,先将两种不同液体分别倒入甲、乙容器 2020-07-19 …
甲、乙两个形状未知的容器的底面积之比为S甲:S乙=4:3,两容器内盛有同一种液体,如果两容器底面积所 2020-11-29 …
三个容器的底面积S甲=S乙>S丙,容器内盛有三种液体,其液面是这样的:三个容器的高度一样,宽度是甲跟 2021-01-16 …