早教吧作业答案频道 -->化学-->
生产MnO2和Zn的工艺简化流程如图所示(中间产物的固体部分已经略去):软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%.滤液B中含金属离子:Zn2+、Mn2+、
题目详情
生产MnO2和Zn的工艺简化流程如图所示(中间产物的固体部分已经略去):
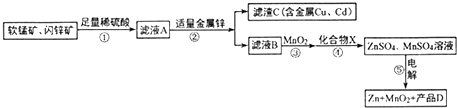
软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%.滤液B中含金属离子:Zn2+、Mn2+、Fe2+、Al3+.
试求下列问题:
(1)步骤①中软锰矿、闪锌矿与硫酸溶液共热时可析出硫,且金属元素均转化为相应的硫酸盐(铁元素以+3价存在).则其中MnO2和FeS发生反应的离子方程式为___.
(2)步骤③中的MnO2也可用下列___(填字母)物质代替(不考虑Mn2+的反应).
A.KMnO4固体 B.H2O2 C.浓硝酸 D.新制氯水
(3)步骤⑤电解过程中阳极的电极反应式为___(使用惰性电极).
(4)加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,则产品D为___(填化学式).
(5)Ⅰ.将制得的MnO2(s)与KOH(s)、KClO3(s)按比例混合,加热熔融(不断搅拌)可得KCl和K2MnO4的固体混合物.
Ⅱ.再用5%的KOH溶液溶解得绿色(MnO42-的颜色)溶液;
Ⅲ.向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣[含MnO2(s)];
Ⅳ.将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体.
①第Ⅲ步操作中“趁热过滤”的目的是___.
②写出Ⅲ中生成KMnO4的化学方程式:___.
③Ⅲ中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是___.

软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%.滤液B中含金属离子:Zn2+、Mn2+、Fe2+、Al3+.
试求下列问题:
(1)步骤①中软锰矿、闪锌矿与硫酸溶液共热时可析出硫,且金属元素均转化为相应的硫酸盐(铁元素以+3价存在).则其中MnO2和FeS发生反应的离子方程式为___.
(2)步骤③中的MnO2也可用下列___(填字母)物质代替(不考虑Mn2+的反应).
A.KMnO4固体 B.H2O2 C.浓硝酸 D.新制氯水
(3)步骤⑤电解过程中阳极的电极反应式为___(使用惰性电极).
(4)加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,则产品D为___(填化学式).
(5)Ⅰ.将制得的MnO2(s)与KOH(s)、KClO3(s)按比例混合,加热熔融(不断搅拌)可得KCl和K2MnO4的固体混合物.
Ⅱ.再用5%的KOH溶液溶解得绿色(MnO42-的颜色)溶液;
Ⅲ.向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣[含MnO2(s)];
Ⅳ.将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体.
①第Ⅲ步操作中“趁热过滤”的目的是___.
②写出Ⅲ中生成KMnO4的化学方程式:___.
③Ⅲ中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是___.
▼优质解答
答案和解析
软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%,软锰矿、闪锌矿与硫酸溶液共热时可析出硫,滤液A为硫酸铁、硫酸锰、硫酸铝、硫酸铜、硫酸镉的水溶液,加入适量金属锌,锌和铁离子反应生成锌离子和亚铁离子,锌和铜离子反应生成铜和锌离子,滤液B中含金属离子:Zn2+、Mn2+、Fe2+、Al3+,过滤得到滤渣为铜、镉,滤液B中加入二氧化锰氧化亚铁离子为铁离子,加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,电解ZnSO4、MnSO4溶液得到锌、二氧化锰和D为硫酸,
(1)MnO2和FeS在酸溶液中发生氧化还原反应生成硫单质、硫酸锰、硫酸铁和水,结合电荷守恒和原子守恒配平书写离子方程式为:3MnO2+2FeS+12H+
2Fe3++3Mn2++2S+6H2O,
故答案为:3MnO2+2FeS+12H+
2Fe3++3Mn2++2S+6H2O;
(2)代替二氧化锰氧化亚铁离子不能引入难易除去的杂质,
A.KMnO4固体会氧化亚铁离子,但会引入钾离子,故A不符合;
B.H2O2 可以氧化亚铁离子,且不引入新的杂质,故B符合;
C.浓硝酸会氧化亚铁离子,但会引入硝酸根离子,故C不符合;
D.新制氯水可以氧化亚铁离子,但会引入氯离子,故D不符合;
故答案为:B;
(3)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(4)加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:H2SO4;
(5)①趁热过滤防止高锰酸钾析出,第Ⅲ步操作中“趁热过滤”的目的是防止温度降低,KMnO4晶体析出导致产率下降,
故答案为:防止温度降低,KMnO4晶体析出导致产率下降;
②向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣含MnO2(s)将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体 生成产物为二氧化锰、高锰酸钾和碳酸钾,反应的化学方程式为:2CO2+3K2MnO4
2KMnO4+MnO2↓+2K2CO3,
故答案为:2CO2+3K2MnO4
2KMnO4+MnO2↓+2K2CO3;
③二氧化碳过量会生成溶解度小的碳酸氢钾随高锰酸钾晶体析出混入杂质,③Ⅲ中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出,
故答案为:通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出.
(1)MnO2和FeS在酸溶液中发生氧化还原反应生成硫单质、硫酸锰、硫酸铁和水,结合电荷守恒和原子守恒配平书写离子方程式为:3MnO2+2FeS+12H+
| ||
故答案为:3MnO2+2FeS+12H+
| ||
(2)代替二氧化锰氧化亚铁离子不能引入难易除去的杂质,
A.KMnO4固体会氧化亚铁离子,但会引入钾离子,故A不符合;
B.H2O2 可以氧化亚铁离子,且不引入新的杂质,故B符合;
C.浓硝酸会氧化亚铁离子,但会引入硝酸根离子,故C不符合;
D.新制氯水可以氧化亚铁离子,但会引入氯离子,故D不符合;
故答案为:B;
(3)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(4)加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:H2SO4;
(5)①趁热过滤防止高锰酸钾析出,第Ⅲ步操作中“趁热过滤”的目的是防止温度降低,KMnO4晶体析出导致产率下降,
故答案为:防止温度降低,KMnO4晶体析出导致产率下降;
②向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣含MnO2(s)将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体 生成产物为二氧化锰、高锰酸钾和碳酸钾,反应的化学方程式为:2CO2+3K2MnO4
| ||
故答案为:2CO2+3K2MnO4
| ||
③二氧化碳过量会生成溶解度小的碳酸氢钾随高锰酸钾晶体析出混入杂质,③Ⅲ中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出,
故答案为:通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出.
看了 生产MnO2和Zn的工艺简化...的网友还看了以下:
关于Cl[2]O的一道题Cl[2]O常用NaClO[3]和Na[2]SO[3]溶液混合并加H[2] 2020-04-11 …
在⊙O中,AB为直径,点C为圆上一点,将劣弧沿弦AC翻折交AB于点D,连结CD.(1)如图1,若点 2020-06-23 …
弧,玄,圆心角题(1)圆O中,玄AB=3,圆心角AOB=120,则圆O的半径是?(2)A,B,C, 2020-07-02 …
高中数学已知直三棱柱ABC-A1B1C1的底面三角形ABC中,角C=90度,BC=√2,BB1=2 2020-07-09 …
如图1,在⊙O中,AB为⊙O的直径,AC是弦,OC=4,∠OAC=60度.(1)求∠AOC的度数; 2020-07-13 …
倒置A2/O中的A2O分别代表什么?为什么叫倒置A2/O?万分紧急,还请问什么是倒置A2O这是一种 2020-07-21 …
如图1,在⊙O中,AB为⊙O的直径,AC是弦,OC=4,∠OAC=60度.(1)求∠AOC的度数; 2020-07-30 …
想一想,填一填.1.OX三角=口O+O+O=口—O—O三角=(?)2.O—口=想一想,填一填.1.O 2020-11-04 …
如图1,在⊙O中,E是弧AB的中点,C为⊙O上的一动点(C与E在AB异侧),连接EC交AB于点F,E 2020-12-03 …
1.若集合A={x|(a-1)x^2+2x+1=o}中只含有一个元素,求实数a2.已知集合A={1, 2020-12-07 …