早教吧作业答案频道 -->化学-->
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等.(1)砷的常见氧化物有AS2O3和As2O5,As2O5热稳定性差.根据图1写出As2O5分解为AS2O3的热化学方程式.(2)砷酸钠
题目详情
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等.
(1)砷的常见氧化物有AS2O3和As2O5,As2O5热稳定性差.根据图1写出As2O5分解为AS2O3的热化学方程式___.
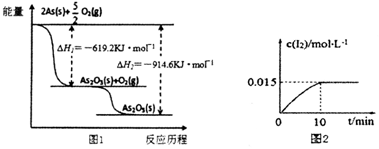
(2)砷酸钠具有氧化性.298K时,在100mL,烧杯中加入10mL0.1mol•L-1Na3AsO4溶液、20mL 0.1mol.L-1KI溶液和20mL 0.05mol/L硫酸溶液,发生反应:
AsO43-+2I-+2H+⇌AsO33-+I2+H2O△H.
(无色) (无色)(浅黄色)
溶液中c(I2)与时间(t)的关系如图2所示(忽略溶液体积变化).
①能够表明上述反应达到平衡状态的是___(填序号).
a.溶液颜色不再变化
b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率
d.c(AsO33-)/c(I2)保持不再变化
②0~10rain内,I-的反应速率v(I-)=___.
③在该条件下,上述反应的平衡常数K=___.
④升温,AsO43-的平衡转化率减小,则该反应的△H___ 0(填“大于”“小于”或“等于”).
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液.
②上述混合液用0.02500mo1.L-1的I2溶液滴定,用___做指示剂进行滴定.重复滴定2次,平均消耗I2溶液40.00mL.则试样中As2O5的质量分数是___.
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为___(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式___.
(1)砷的常见氧化物有AS2O3和As2O5,As2O5热稳定性差.根据图1写出As2O5分解为AS2O3的热化学方程式___.

(2)砷酸钠具有氧化性.298K时,在100mL,烧杯中加入10mL0.1mol•L-1Na3AsO4溶液、20mL 0.1mol.L-1KI溶液和20mL 0.05mol/L硫酸溶液,发生反应:
AsO43-+2I-+2H+⇌AsO33-+I2+H2O△H.
(无色) (无色)(浅黄色)
溶液中c(I2)与时间(t)的关系如图2所示(忽略溶液体积变化).
①能够表明上述反应达到平衡状态的是___(填序号).
a.溶液颜色不再变化
b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率
d.c(AsO33-)/c(I2)保持不再变化
②0~10rain内,I-的反应速率v(I-)=___.
③在该条件下,上述反应的平衡常数K=___.
④升温,AsO43-的平衡转化率减小,则该反应的△H___ 0(填“大于”“小于”或“等于”).
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液.
②上述混合液用0.02500mo1.L-1的I2溶液滴定,用___做指示剂进行滴定.重复滴定2次,平均消耗I2溶液40.00mL.则试样中As2O5的质量分数是___.
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为___(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式___.
▼优质解答
答案和解析
(1)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJ•mol-1;
(2)①AsO43-+2I-+2H+⇌AsO33-+I2+H2O,
(无色) (无色)(浅黄色)
a.溶液颜色不再变化说明离子浓度不变,反应达到平衡状态,故a正确;
b.反应前后守恒可知c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;
c.AsO43-的生成速率等于I2的生成速率,说明反应达到平衡状态,故c正确;
d.AsO33-和I2,生成物质的量相同,c(AsO33-)/c(I2)始终保持不再变化,不能说明反应达到平衡状态,故d错误;
故答案为:ac;
②图2可知,I2浓度变化为0.015mol/L,I-浓度变化0.03mol/L,0-10minv(I-)=
=0.003mol/(L•min),
故答案为:0.003mol/(L•min);
③AsO43-+2I-+2H+⇌AsO33-+I2+H2O
起始量(mol/L) 0.02 0.04 0.04 0 0
变化量(mol/L) 0.015 0.03 0.03 0.015 0.015
平衡量(mol/L)0.005 0.01 0.01 0.015 0.015
K═
=4.5×106,
故答案为:4.5×106;
④升温,AsO43-的平衡转化率减小,说明平衡逆向进行,正反应为放热反应,△H小于0,
故答案为:小于;
(3)②将试样As2O3和As2O50.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液,上述混合液用0.02500mo1.L-1的I2溶液滴定,选择淀粉溶液为指示剂,滴入最后一滴溶液变蓝色,重复滴定2次,平均消耗I2溶液40.00mL.
AsO33-+I2+H2O=AsO43-+2I-+2H+,
1 1
n 0.02500mol/L×0.04000L
n=0.001mol,
则试样中As2O5的质量分数=
×100%=50.5%,
故答案为:淀粉溶液;50.5%;
(4)雄黄在空气中加热至300℃时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为As4S4+7O2
2As2O3+4SO2,另一种氧化物为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式为2H2O2+H2O+As2O3=2H3AsO4,
故答案为:SO2;2H2O2+As2O3+H2O=2H3AsO4.
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJ•mol-1;
(2)①AsO43-+2I-+2H+⇌AsO33-+I2+H2O,
(无色) (无色)(浅黄色)
a.溶液颜色不再变化说明离子浓度不变,反应达到平衡状态,故a正确;
b.反应前后守恒可知c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;
c.AsO43-的生成速率等于I2的生成速率,说明反应达到平衡状态,故c正确;
d.AsO33-和I2,生成物质的量相同,c(AsO33-)/c(I2)始终保持不再变化,不能说明反应达到平衡状态,故d错误;
故答案为:ac;
②图2可知,I2浓度变化为0.015mol/L,I-浓度变化0.03mol/L,0-10minv(I-)=
| 0.03mol/L |
| 10min |
故答案为:0.003mol/(L•min);
③AsO43-+2I-+2H+⇌AsO33-+I2+H2O
起始量(mol/L) 0.02 0.04 0.04 0 0
变化量(mol/L) 0.015 0.03 0.03 0.015 0.015
平衡量(mol/L)0.005 0.01 0.01 0.015 0.015
K═
| 0.015×0.015 |
| 0.005×0.012×0.012 |
故答案为:4.5×106;
④升温,AsO43-的平衡转化率减小,说明平衡逆向进行,正反应为放热反应,△H小于0,
故答案为:小于;
(3)②将试样As2O3和As2O50.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液,上述混合液用0.02500mo1.L-1的I2溶液滴定,选择淀粉溶液为指示剂,滴入最后一滴溶液变蓝色,重复滴定2次,平均消耗I2溶液40.00mL.
AsO33-+I2+H2O=AsO43-+2I-+2H+,
1 1
n 0.02500mol/L×0.04000L
n=0.001mol,
则试样中As2O5的质量分数=
0.2000g-0.001mol×
| ||
| 0.2000g |
故答案为:淀粉溶液;50.5%;
(4)雄黄在空气中加热至300℃时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为As4S4+7O2
| ||
故答案为:SO2;2H2O2+As2O3+H2O=2H3AsO4.
看了 砷元素广泛存在于自然界,砷与...的网友还看了以下:
化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)的能量.以下是部分共价键键能的 2020-04-07 …
下列排列顺序错误的是()A.非金属性As>S>Cl>FB.金属性Rb>K>Mg>AlC.稳定性PH 2020-05-13 …
连字成词(英语)l u o e b s r u s r e t o s w a e s r t e 2020-05-14 …
下列各组词语中,加点字注意全对的一组是()A.百舸(gě)浪遏(è)发酵(jiào)枯槁(gǎo) 2020-06-28 …
A.诗赋(fù)B.衔接(xián)C.潇湘(xiāo)D.潜形(qiǎn)嗟夫(jiē)谪守(z 2020-07-23 …
下列比较错误的是()A.稳定性:HCl>H2S>H3PB.酸性:HNO3>H3PO4>H2SiO3C 2020-12-07 …
下列排列顺序错误的是()A.非金属性As>S>Cl>FB.金属性Rb>K>Mg>AlC.稳定性PH3 2020-12-07 …
下列词语中加点的字读音有错误的一项是A.啮齿(niè)牲畜(chù)拨弄(nòng)塑造(sù)B. 2020-12-12 …
A.嶙峋(lìn)奥恼(ào)骚扰(sāo)茁壮(zuó)B.洗濯(zhuó)沮咒(zhǔ)堕落(d 2020-12-19 …
英文单词分类填空动物类1.O()t()p()s2.k()t()e()3.l()b()t()r4.a( 2021-02-05 …