早教吧作业答案频道 -->化学-->
高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂.其生产流程如下:(1)配制KOH溶液时,是在每100mL水中溶解61.6gKOH固体(该溶液的密度为1.47g/mL),它的物质的
题目详情
高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂.其生产流程如下: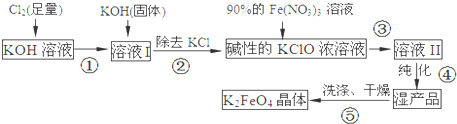
(1)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是___mol/L.
(2)在溶液I中加入KOH固体的目的是___(填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为___ mol.从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式:___.
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是___.

(1)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是___mol/L.
(2)在溶液I中加入KOH固体的目的是___(填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为___ mol.从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式:___.
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是___.
▼优质解答
答案和解析
(1)61.6g KOH固体的物质的量为
=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为
=
L,所以氢氧化钾溶液的物质的量浓度为
=10mol/L,
故答案为:10;
(2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得③中反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
每制得59.4克K2FeO4,物质的量=
=0.3mol,理论上消耗氧化剂为KClO的物质的量 依据离子方程式定量关系计算,
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
3 2
n 0.3mol
n=0.45mol
故答案为:0.45,2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)向高铁酸钾溶液中滴加稀硫酸,溶液变黄色,说明生成Fe3+,并产生大量气泡,应为氧气,反应的离子方程式为4FeO42-+20 H+=4Fe3++3O2↑+10H2O,说明高铁酸钾在酸性条件下自身发生氧化还原反应,
故答案为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O.
| 61.6g |
| 56g/mol |
| 161.6g |
| 1.47×10-3g/L |
| 161.6 |
| 1470 |
| 1.1mol | ||
|
故答案为:10;
(2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得③中反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
每制得59.4克K2FeO4,物质的量=
| 59.4g |
| 198g/mol |
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
3 2
n 0.3mol
n=0.45mol
故答案为:0.45,2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)向高铁酸钾溶液中滴加稀硫酸,溶液变黄色,说明生成Fe3+,并产生大量气泡,应为氧气,反应的离子方程式为4FeO42-+20 H+=4Fe3++3O2↑+10H2O,说明高铁酸钾在酸性条件下自身发生氧化还原反应,
故答案为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O.
看了 高铁酸钾(K2FeO4)是一...的网友还看了以下:
1.七水和硫酸亚铁是否是纯净物2.二氧化氮经过加压凝成无色液体是否有新物质生成3.下列反应中加入的 2020-05-13 …
最后一道题:王家新在《山的那边》这首诗里写道:“在山的那边,是海!是用信念凝成的海。”“新年凝成的 2020-05-14 …
密度比空气小的物体会自己飞起来吗?我在腾讯新闻的视频上看到一条新闻,说中国科学家发明了一种新物体, 2020-05-19 …
某研究小组以水杨酸和甲苯为主要原料,按下列路线合成抗血栓药物--新抗凝.已知:RCOOR′+CH3 2020-06-24 …
在废水处理中,(见问题补充)既然处理成小颗粒,为什么又要处理成大颗粒那?矾花又是什么?在废水处理中 2020-06-25 …
凝结水中的杂质主要来源于哪里?电厂凝结水中的杂质主要来源于锅炉补给水中的微量含盐量,锅炉管道系统中 2020-07-05 …
观察新鲜凝血块的表面和切面,分析回答下列问题:(1)新鲜凝血块表面的颜色是,其原因是。(2)刚切开 2020-07-05 …
某研究小组以水杨酸和甲苯为主要原料,按下列路线合成抗血栓药物--新抗凝.已知:RCHO+CH3CO 2020-07-10 …
在水中加絮凝剂后,会发生化学反应吗?会的话,产生什么新物质 2020-07-14 …
请根据你对课本实验的观察,填写下表实验变化时发生的现象变化后有无新物质生成①给水加热液态水沸腾,产生 2020-11-04 …