早教吧作业答案频道 -->化学-->
碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示.放电时总反应为:Zn+2H2O+2MnO2═Zn(OH)2+2MnOOH从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:回答下列问题:(1)MnOOH中,M
题目详情
碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示.放电时总反应为:
Zn+2H2O+2MnO2═Zn(OH)2+2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:
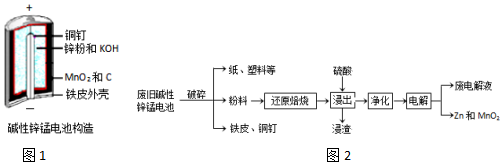
回答下列问题:
(1)MnOOH中,Mn元素的化合价为___.
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有___.
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入___(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀.已知浸出液中Mn2+、Zn2+的浓度约为0.1mol•L-1,根据下列数据计算,调节pH的合理范围是___至___.
(离子浓度小于1×10-5mol•L-1即为沉淀完全)
(4)“电解”时,阳极的电极反应式为___.本工艺中应循环利用的物质是___(填化学式).
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2.“粉料”中的MnOOH与盐酸反应的化学方程式为___.
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效.如果制造一节电池所需的锌粉为6g,则电池失效时仍有___%的金属锌未参加反应.
Zn+2H2O+2MnO2═Zn(OH)2+2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:

回答下列问题:
(1)MnOOH中,Mn元素的化合价为___.
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有___.
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入___(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀.已知浸出液中Mn2+、Zn2+的浓度约为0.1mol•L-1,根据下列数据计算,调节pH的合理范围是___至___.
| 化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
| KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为___.本工艺中应循环利用的物质是___(填化学式).
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2.“粉料”中的MnOOH与盐酸反应的化学方程式为___.
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效.如果制造一节电池所需的锌粉为6g,则电池失效时仍有___%的金属锌未参加反应.
▼优质解答
答案和解析
(1)根据化合价代数和为0,MnOOH中,Mn元素的化合价为+3价,故答案为:+3;
(2)废旧碱性锌锰电池粉料中含有碳具有还原性,“还原焙烧”过程中,碳将高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),故答案为:C;
(3)“净化”是为了除去浸出液中的Fe2+,利用H2O2溶液具有氧化性将Fe2+氧化为Fe3+,再由Mn(OH)2、Zn(OH)2的KSP近似值可求得Mn2+,Zn2+开始沉淀时的氢氧根浓度分别为
=10-6,
=10-8,即Mn2+,Zn2+开始沉淀时的pH分别为8和6,而Fe(OH)3沉淀完全时的氢氧根浓度为
=10-11,即
Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀,故答案为:H2O2;3;6;
(4)电解阳极Mn2+失电子发生氧化反应生成MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,阴极Zn2+得电子发生还原反应生成Zn,废电解液为硫酸,则本工艺中应循环利用的物质是H2SO4,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;
(5)“粉料”中的MnOOH具有氧化性,与盐酸发生氧化还原反应,则反应的化学方程式为2MnOOH+6HCl
2MnCl2+4H2O+Cl2↑,故答案为:2MnOOH+6HCl
2MnCl2+4H2O+Cl2↑;
(6)80分钟转移电子的物质的量为5×10-6 mol×80×60=0.024mol,则消耗的Zn的质量为
×65g/mol=0.78g,所以如果制造一节电池所需的锌粉为6g,则电池失效时仍有
×100%=87%的金属锌未参加反应,故答案为:87.
(2)废旧碱性锌锰电池粉料中含有碳具有还原性,“还原焙烧”过程中,碳将高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),故答案为:C;
(3)“净化”是为了除去浸出液中的Fe2+,利用H2O2溶液具有氧化性将Fe2+氧化为Fe3+,再由Mn(OH)2、Zn(OH)2的KSP近似值可求得Mn2+,Zn2+开始沉淀时的氢氧根浓度分别为
|
|
| 3 |
| ||
Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀,故答案为:H2O2;3;6;
(4)电解阳极Mn2+失电子发生氧化反应生成MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,阴极Zn2+得电子发生还原反应生成Zn,废电解液为硫酸,则本工艺中应循环利用的物质是H2SO4,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;
(5)“粉料”中的MnOOH具有氧化性,与盐酸发生氧化还原反应,则反应的化学方程式为2MnOOH+6HCl
| ||
| ||
(6)80分钟转移电子的物质的量为5×10-6 mol×80×60=0.024mol,则消耗的Zn的质量为
| 0.024mol |
| 2 |
| 6-0.78 |
| 6 |
看了 碱性锌锰电池是日常生活中消耗...的网友还看了以下:
已知某池塘养殖着鲤鱼和鲫鱼,为了估计这两种鱼的数量,养殖者从池塘中捕出这两种鱼各1000条,给每条 2020-05-17 …
已知某池塘养殖着鲤鱼和鲫鱼,为了估计这两种鱼的数量,养殖者从池塘中捕出两种鱼各1000只,给每只鱼 2020-07-02 …
碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示.放电时总反应为:Zn+2H2O+2Mn 2020-07-13 …
已知镉(Cd)的金属活动性与铁、锌相近,镉元素在化合物中常显+2价.(1)写出镉与硫酸铜溶液反应的 2020-07-30 …
某课题研究小组,收集了数码相机,手机等用旧了的各种类型的电池,以及从废旧收音机上拆下的电阻、电容、电 2020-11-20 …
某课题研究小组,收集了数码相机、手机等用旧了的各种类型的电池及从废旧收音机上拆下的电阻、电容和电感线 2020-11-20 …
在一次课外实践活动中,某课题研究小组收集到数码相机、手机等电子产品中的一些旧电池以及从废旧收音机上拆 2020-11-20 …
1.废干电池中回收的物质有什么用途?2.常用的电池有多少种:形状,体积,售价,能否反复使用,使用多长 2020-11-22 …
某课题研究小组的同学收集了数码相机、手机等用旧了的各种类型的电池及从废旧收音机上拆下的电阻、电容、电 2021-01-02 …
(13分)某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、、、等物质,整个实验过程如下 2021-02-01 …