早教吧作业答案频道 -->化学-->
MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:(1)第①步反应中的硫酸能否用浓盐酸代替?(填“能”或“否”),理由是
题目详情
MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:
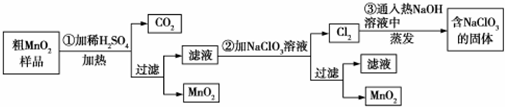
(1)第①步反应中的硫酸能否用浓盐酸代替?___(填“能”或“否”),理由是___.
(2)第②步操作中,氧化性强弱顺序:ClO3-___MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式:___;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol.
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH.
①制取K2MnO4的化学反应方程式为___,工业上不断搅拌的目的是___.
②电解K2MnO4的浓溶液时,电解的总反应方程式为___.
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3═2NaI+Na2S4O6
取较为纯净的二氧化锰样品ag加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为___%(杂质不参与反应).

(1)第①步反应中的硫酸能否用浓盐酸代替?___(填“能”或“否”),理由是___.
(2)第②步操作中,氧化性强弱顺序:ClO3-___MnO2(填“>”或“<”),写出操作②中发生反应的离子方程式:___;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol.
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4挡板浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH.
①制取K2MnO4的化学反应方程式为___,工业上不断搅拌的目的是___.
②电解K2MnO4的浓溶液时,电解的总反应方程式为___.
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3═2NaI+Na2S4O6
取较为纯净的二氧化锰样品ag加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为___%(杂质不参与反应).
▼优质解答
答案和解析
(1)二氧化锰有氧化性,在加热时浓盐酸能被MnO2氧化生成Cl2,所以不能用盐酸代替硫酸,
故答案为:否;浓盐酸能被MnO2氧化生成Cl2;
(2)操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;1;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,反应的方程式为2MnO2+4KOH+O2=2 K2MnO4+2H2O,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触,
故答案为:2MnO2+4KOH+O2=2 K2MnO4+2H2O;使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气,电解的总反应方程式为2 K2MnO4+2H2O═KMnO4+2KOH+H2↑,
故答案为:2 K2MnO4+2H2O═KMnO4+2KOH+H2↑;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据题意可知Na2S2O3的物质的量为0.1000mol/L×0.001VL=0.0001Vmol,所以二氧化锰的质量为0.0001Vmol×87g/mol×
=0.00435Vg,则该样品中MnO2含量为
×100%=
%,
故答案为:
.
故答案为:否;浓盐酸能被MnO2氧化生成Cl2;
(2)操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;1;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,反应的方程式为2MnO2+4KOH+O2=2 K2MnO4+2H2O,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触,
故答案为:2MnO2+4KOH+O2=2 K2MnO4+2H2O;使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气,电解的总反应方程式为2 K2MnO4+2H2O═KMnO4+2KOH+H2↑,
故答案为:2 K2MnO4+2H2O═KMnO4+2KOH+H2↑;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据题意可知Na2S2O3的物质的量为0.1000mol/L×0.001VL=0.0001Vmol,所以二氧化锰的质量为0.0001Vmol×87g/mol×
| 1 |
| 2 |
| 0.00435Vg |
| ag |
| 0.435V |
| a |
故答案为:
| 0.435V |
| a |
看了 MnO2是一种重要的化工原料...的网友还看了以下:
有关英语语法!求指教!nonewsis()goodnews.在括号中填上a,an,the,或不填. 2020-05-14 …
毛细管柱色谱和填充柱色谱的区别是什么?应能上有何差别?能否以毛细管柱色谱完全代 2020-05-16 …
125BroadStreet,18thFloor,NewYorkNY10004我想写信到美国给这个 2020-05-23 …
催化剂装填应( )。A、随意装填B、密相装填C、稀相装填D、自上而下 2020-05-31 …
判断一种生产关系是否优越的主要标准是看它( )A.是否适应了上层建筑发展的要求 B.是否 2020-06-05 …
判断一种生产关系是否优越的主要标准是看它( ) A.是否适应了上层建筑发展的要求B.是否扩大了 2020-06-06 …
今天下午我们期末考试,如梦令昨夜风疏雨骤中的描写景色的句子一共有两个空是填知否知否,应是绿肥红瘦还 2020-07-04 …
GDP核算中,重置投资或折旧应否计入?书上说,重置投资(支出法)或折旧(收入法)应当计入GDP。但 2020-07-07 …
请在括号里填写与加粗的词相对的反义词。1.我们不应()一切,也不应否定一切。2.那个纸箱的秘密,现在 2020-12-28 …
硅与水反应否?我看见辅导书上说硅与氢氧化钠反应的实际反应过程是硅与水反应生成硅酸和氢气,硅酸和氢氧化 2021-02-02 …