早教吧作业答案频道 -->化学-->
某兴趣小组设计SO2实验方案做以下化学实验.Ⅰ.实验方案一(1)将SO2通入水中形成“SO2─饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为.(2)已知
题目详情
某兴趣小组设计SO2实验方案做以下化学实验.
Ⅰ.实验方案一
(1)将SO2通入水中形成“SO2─饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为___.
(2)已知:葡萄酒中有少量SO2可以做抗氧化剂[我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L].
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如图1的实验:
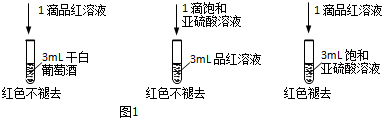
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:___.
Ⅱ.实验方案二
如图2是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出.
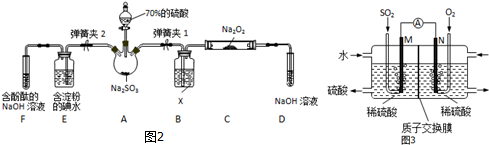
(1)装置B中试剂X是___,装置D中盛放NaOH溶液的作用是___.
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是___.
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为___;发生反应的离子方程式是___.
Ⅲ.实验方案三
用电化学法模拟工业处理S02.将硫酸工业尾气中的S02通入图3装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
(1)M极发生的电极反应式为___.
(2 )若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为___L(已知:1个e所带电量为1.6×10-19C).
Ⅰ.实验方案一
(1)将SO2通入水中形成“SO2─饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为___.
(2)已知:葡萄酒中有少量SO2可以做抗氧化剂[我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L].
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如图1的实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:___.
Ⅱ.实验方案二
如图2是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出.

(1)装置B中试剂X是___,装置D中盛放NaOH溶液的作用是___.
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是___.
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为___;发生反应的离子方程式是___.
Ⅲ.实验方案三
用电化学法模拟工业处理S02.将硫酸工业尾气中的S02通入图3装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
(1)M极发生的电极反应式为___.
(2 )若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为___L(已知:1个e所带电量为1.6×10-19C).
▼优质解答
答案和解析
Ⅰ.实验方案一:(1)二氧化硫与水反应生成亚硫酸,亚硫是二元弱酸,能分步电离,涉及的平衡方程式为SO2(g)⇌SO2(aq)、SO2+H2O⇌H2SO3、H2SO3⇌H++HSO3-、HSO3-⇌H++SO32-,
故答案为:SO2(g)⇌SO2(aq)、SO2+H2O⇌H2SO3、H2SO3⇌H++HSO3-、HSO3-⇌H++SO32-;
(2)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果,干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少,
故答案为:干白中二氧化硫或亚硫酸含量太少;
Ⅱ.实验方案二:装置A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气.
(1)装置B中试剂X干燥氯气,盛放试剂是浓硫酸,装置D中盛放NaOH溶液的作用是:吸收未反应的SO2,防止污染空气,
故答案为:浓硫酸;吸收未反应的SO2,防止污染空气;
(2)检验SO2与Na2O2反应是否有氧气生成的方法是:将带火星的木条放在D试管口处,看木条是否复燃,
故答案为:将带火星的木条放在D试管口处,看木条是否复燃;
(3)能说明I-还原性弱于SO2的现象为:E中溶液蓝色褪去,发生反应的离子方程式是:SO2+I2+2H2O=2I-+SO42-+4H+,
故答案为:E中溶液蓝色褪去; SO2+I2+2H2O=2I-+SO42-+4H+;
Ⅲ.实验方案三:(1)本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,
故答案为:SO2+2H2O-2e -═SO42-+4H+;
(2)转移电子物质的量为(2A×60s÷1.6×10-19C)÷6.02×1023mol-1,则需要二氧化硫体积为:[(2A×60s÷1.6×10-19C)÷6.02×1023mol-1]÷2×22.4L/mol≈0.014L,
故答案为:0.014.
故答案为:SO2(g)⇌SO2(aq)、SO2+H2O⇌H2SO3、H2SO3⇌H++HSO3-、HSO3-⇌H++SO32-;
(2)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果,干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少,
故答案为:干白中二氧化硫或亚硫酸含量太少;
Ⅱ.实验方案二:装置A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气.
(1)装置B中试剂X干燥氯气,盛放试剂是浓硫酸,装置D中盛放NaOH溶液的作用是:吸收未反应的SO2,防止污染空气,
故答案为:浓硫酸;吸收未反应的SO2,防止污染空气;
(2)检验SO2与Na2O2反应是否有氧气生成的方法是:将带火星的木条放在D试管口处,看木条是否复燃,
故答案为:将带火星的木条放在D试管口处,看木条是否复燃;
(3)能说明I-还原性弱于SO2的现象为:E中溶液蓝色褪去,发生反应的离子方程式是:SO2+I2+2H2O=2I-+SO42-+4H+,
故答案为:E中溶液蓝色褪去; SO2+I2+2H2O=2I-+SO42-+4H+;
Ⅲ.实验方案三:(1)本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,
故答案为:SO2+2H2O-2e -═SO42-+4H+;
(2)转移电子物质的量为(2A×60s÷1.6×10-19C)÷6.02×1023mol-1,则需要二氧化硫体积为:[(2A×60s÷1.6×10-19C)÷6.02×1023mol-1]÷2×22.4L/mol≈0.014L,
故答案为:0.014.
看了 某兴趣小组设计SO2实验方案...的网友还看了以下:
(2009•防城港)如图是小海同学“研究定滑轮和动滑轮特点”的实验装置.他按图示提起钩码时注意保持 2020-06-30 …
某小组同学通过实验研究物体浸没在水中时测力计示数F与哪些因素有关,他们将体积相同的球体A、圆锥体B 2020-07-11 …
1)我校有9名男同学1分钟跳绳成绩如下:102,10,91,96,106,110,182,100这 2020-07-30 …
先锋小学三(1)班开展学雷锋活动.填写下面的统计表,再完成统计图并回答问题.(1)三(1)班开展学 2020-07-31 …
如表是光明中学七年级(2)班同学参加学校课外兴趣小组情况统计表科学数学体育外语美术人数642010 2020-07-31 …
某班A、B两组各有8名学生,他们期中考试的美术成绩如下:A组66,68,72,74,76,78,8 2020-08-03 …
如表是我市抽查部分高中学生的身高统计表,从左到右的各组表示的学生人数依次记为A1,A2,…,A10( 2020-10-31 …
教材中给出了Na2O2与H2O反应的化学方程式.为了探究Na2O2与H2O反应的机理,某学习探究小组 2020-11-21 …
下面是三年一班和三年二班同学参加兴趣小组的人数统计表三年一班同学参加兴趣小组人数统计表组别书画小组声 2020-12-04 …
1、根据下面的材料,拟定一份通知为庆祝国庆节,平丰电大04级会计专业班班委会决定在10月2日组织一次 2021-01-22 …