早教吧作业答案频道 -->化学-->
银,铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图1所示:(1)酸浸时反应的离子方程式为.为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进
题目详情
银,铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图1所示: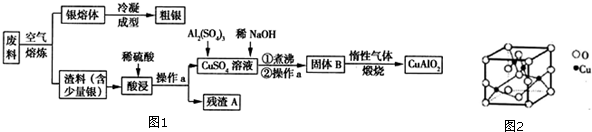
(1)酸浸时反应的离子方程式为___.为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是___.
(2)操作a是___,已知2Cu+
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点___.
(3)固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
___CuO+___Al2O3
___+___↑.
(4)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差___g.
(5)熔炼时被氧化的元素铜生成氧化物其晶胞如图2所示,若晶胞的边长为acm.则晶体的密度为___g•cm-3,(写出含a的表示式,用NA表示阿伏加德罗常数的值)

(1)酸浸时反应的离子方程式为___.为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是___.
(2)操作a是___,已知2Cu+
| H+ |
| |
(3)固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
___CuO+___Al2O3
| ||
(4)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差___g.
(5)熔炼时被氧化的元素铜生成氧化物其晶胞如图2所示,若晶胞的边长为acm.则晶体的密度为___g•cm-3,(写出含a的表示式,用NA表示阿伏加德罗常数的值)
▼优质解答
答案和解析
由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水,反应离子方程式为:CuO+2H+=Cu2++H2O;将渣料粉碎,增大接触面积,加快反应速率;
故答案为:CuO+2H+=Cu2++H2O;将渣料粉碎;
(2)操作a是分离互不相溶的液体与固体,应是过滤,CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝,现象为得到蓝色溶液、有红色固体生成;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO,溶液变蓝色,相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生,
故答案为:过滤;相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生;
(3)由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,反应前Cu为+2价,反应后为+1,化合价降低1,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:4; 2; 4CuAlO2;O2;
(4)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag与Cu的质量之差,设Cu为xmol,根据电子转移守恒,则Cu放电形成Ag为2x mol,故2x×108-64x=30.4,解得x=0.2,两个电极上银质量的变化值之差为Cu放电生成Ag的质量,故为0.2mol×2×108g/mol=43.2g,
故答案为:43.2;
(5)O原子在晶胞的顶点和体心,故O原子数=8×
=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,则该氧化物的密度ρ=
=
g/cm3.
故答案为:
.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水,反应离子方程式为:CuO+2H+=Cu2++H2O;将渣料粉碎,增大接触面积,加快反应速率;
故答案为:CuO+2H+=Cu2++H2O;将渣料粉碎;
(2)操作a是分离互不相溶的液体与固体,应是过滤,CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝,现象为得到蓝色溶液、有红色固体生成;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO,溶液变蓝色,相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生,
故答案为:过滤;相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生;
(3)由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,反应前Cu为+2价,反应后为+1,化合价降低1,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:4; 2; 4CuAlO2;O2;
(4)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag与Cu的质量之差,设Cu为xmol,根据电子转移守恒,则Cu放电形成Ag为2x mol,故2x×108-64x=30.4,解得x=0.2,两个电极上银质量的变化值之差为Cu放电生成Ag的质量,故为0.2mol×2×108g/mol=43.2g,
故答案为:43.2;
(5)O原子在晶胞的顶点和体心,故O原子数=8×
| 1 |
| 8 |
| m |
| V |
| 320 |
| a3×NA |
故答案为:
| 320 |
| a3×NA |
看了 银,铜均属于重金属,从银铜合...的网友还看了以下:
若1L工业废水转化后所得溶液中铬元素质量为28.6g,CrO42-有1011转化为CrO72-(已 2020-05-14 …
英语翻译哪位兄弟帮我翻译一下:(本文以化工废水为研究对象,总结了现行的环境水样前处理技术.化工废水 2020-05-23 …
映射中,元素、元素的对应,在多对一或者一对一的前提下,元素的对应中可以有没有元素中原像吗?我不知道 2020-06-27 …
工业废弃物对环境的危害极大,硫酸工业废渣废弃物的主要成分为MgO、Al2O3、Fe2O3、SiO2 2020-06-30 …
自行车的前轮轮胎行驶9000千米后报废,后轮轮胎行驶7000千米后报废,前后轮胎可在适合时候交换位 2020-07-16 …
自行车的前轮轮胎行驶9000千米后报废,后轮轮胎行驶7000千米后报废,前后轮胎可在适合时候交换位 2020-07-20 …
自行车的前轮轮胎行驶9000千米后报废,后轮轮胎行驶7000千米后报废,前后轮胎可在适合时候交换位 2020-07-20 …
谁知道元素相对原子质量与道元素近似相对原子质量.计算公式是什么?那前一个公式就是M=12m/碳十二 2020-08-02 …
据新华网报道,我国是电池生产和使用大国,每年电池的产量和消费量达140亿只以上,占世界总产量的三分之 2020-12-21 …
我国是电池生产和使用大国,每年电池的产量和消费量达140亿只以上,占世界总产量的三分之一.我国目前对 2020-12-21 …