早教吧作业答案频道 -->化学-->
高纯晶体硅是信息技术的关键材料.(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=(2)粗硅经系
题目详情
高纯晶体硅是信息技术的关键材料.
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=___
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:___.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用___方法提纯SiHCl3.
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g)⇌Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图3所示.
下列说法正确的是___(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是___,b电极上的电极反应式是___.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=___.
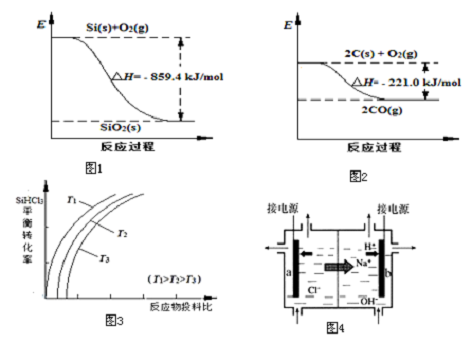
(1)工业上用石英砂和焦炭可制得粗硅.已知:图1、图2请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=___
(2)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:___.
(3)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,
可用___方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
下列说法正确的是___(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是n(SiHCl3)/n( H2)
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图4所示),其中进入阳极室的溶液是___,b电极上的电极反应式是___.
(4)二氧化硅大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283kg在高温下完全反应时放出CO2 44kg,生产出的玻璃可用化学式Na2SiO3•CaSiO3•xSiO2表示,则其中x=___.

▼优质解答
答案和解析
(1)根据两个反应过程能量变化图象可知:Si(s)+O2(s)═SiO2(s)△H=-859.4 kJ•mol-1
2C(s)+O2(s)═2CO(g)△H=-221.0 kJ•mol-1,用第二个方程式减去第一个方程式得出所需反应,SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1,得到△H=+638.4 kJ•mol-1,
故答案为:+638.4 kJ•mol-1;
(2)硅烷的分解温度远低于甲烷,是因为C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,
故答案为:C和Si最外层电子数相同,C原子半径小于Si;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法,故答案为:蒸馏(或分馏);
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
,故b错误;
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度,故c正确;
故选ac;
③阳极室是氯离子放电,所以阳极式应充入氯化钠,b电极是阴极,氢离子在该极放电,所以电极反应式是2H++2e-=H2↑,
故答案为:精制的饱和食盐水;2H++2e-═H2↑
(4)玻璃的化学组成可根据反应原理得到,
Na2CO3+SiO2
NaSiO3+CO2↑;CaCO3+SiO2
CaSiO3+CO2↑;
由化学式Na2SiO3•CaSiO3•xSiO2反应的Na2CO3和CaCO3的物质的量相等,
n(CO2)=n(Na2CO3)+n(CaCO3)=n(SiO2反应)=
=1000mol;
n(Na2CO3)=n(CaCO3)=500mol
500molNa2CO3的质量是53kg,500molCaCO3的质量是50kg,1000molSiO2的质量是60kg,
n(SiO2过量)=
=2000mol,
即剩余的二氧化硅和生成的硅酸钙、硅酸钠为2000:500:500=4:1:1,
所以x=4,故答案为:4.
2C(s)+O2(s)═2CO(g)△H=-221.0 kJ•mol-1,用第二个方程式减去第一个方程式得出所需反应,SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1,得到△H=+638.4 kJ•mol-1,
故答案为:+638.4 kJ•mol-1;
(2)硅烷的分解温度远低于甲烷,是因为C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,
故答案为:C和Si最外层电子数相同,C原子半径小于Si;
(3)①根据各物质沸点的不同分离提纯物质,可用蒸馏(或分馏)法,故答案为:蒸馏(或分馏);
②a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是
| n(H2) |
| n(SiHCl3) |
c.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,故实际生产中为提高SiHCl3的利用率,应适当升高温度,故c正确;
故选ac;
③阳极室是氯离子放电,所以阳极式应充入氯化钠,b电极是阴极,氢离子在该极放电,所以电极反应式是2H++2e-=H2↑,
故答案为:精制的饱和食盐水;2H++2e-═H2↑
(4)玻璃的化学组成可根据反应原理得到,
Na2CO3+SiO2
| ||
| ||
由化学式Na2SiO3•CaSiO3•xSiO2反应的Na2CO3和CaCO3的物质的量相等,
n(CO2)=n(Na2CO3)+n(CaCO3)=n(SiO2反应)=
| 44kg |
| 44g |
n(Na2CO3)=n(CaCO3)=500mol
500molNa2CO3的质量是53kg,500molCaCO3的质量是50kg,1000molSiO2的质量是60kg,
n(SiO2过量)=
| 283kg-50kg-53kg-60kg |
| 60g |
即剩余的二氧化硅和生成的硅酸钙、硅酸钠为2000:500:500=4:1:1,
所以x=4,故答案为:4.
看了 高纯晶体硅是信息技术的关键材...的网友还看了以下:
(2013•安徽模拟)半导体工业用石英砂做原料通过三个重要反应生产单质硅SiO2(s)(石英砂)+ 2020-06-29 …
电子工业中清冼硅片上的二氧化硅的反应是:SiO2(s)+4HF(g)==SiF4(g)+2H2O( 2020-07-14 …
已知碳、一氧化碳、晶体硅的燃烧热分别是△H=-393.5kJ/mol、△H="-283"kJ/mo 2020-07-19 …
已知碳、一氧化碳、晶体硅的燃烧热分别是△H=-393.5kJ/mol、△H=-283kJ/mol和 2020-07-19 …
(14分)高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g) 2020-07-25 …
(14分)高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g) 2020-07-25 …
(14分)高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g) 2020-07-25 …
关于可控硅的特性我有几句话看不懂(请说得通俗一些)可控硅分单向可控硅、双向可控硅.单向可控硅有阳极 2020-07-29 …
工业上用“三氯氢硅还原法”,提纯粗硅的工艺流程如图所示:(1)三氯氢硅的制备原理:Si(s)+3H 2020-08-01 …
请问自动控制原理中C(s)/R(s)是开环传递函数还是闭环传递函数?看到书上有说G(s)=C(s)/ 2020-11-24 …