早教吧作业答案频道 -->化学-->
已知2H2(g)+O2(g)2H2O(l)ΔH=-571.6kJ·mol-1,CO(g)+O2(g)CO2(g)ΔH=-282.8kJ·mol-1,现有CO、H2和CO2组成的混合气体67.2L(标准状况)。经完全燃烧后放出的总热量为710.1kJ,并生成18g水,则原混合气体中
题目详情
已知2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1,CO(g)+
2H2O(l) ΔH=-571.6 kJ·mol-1,CO(g)+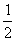 O2(g)
O2(g) CO2(g) ΔH=-282.8 kJ·mol-1,现有CO、H2和CO2组成的混合气体
CO2(g) ΔH=-282.8 kJ·mol-1,现有CO、H2和CO2组成的混合气体67.2 L (标准状况)。经完全燃烧后放出的总热量为710.1 kJ,并生成18 g 水,则原混合气体中CO的体积分数为( )
A.80% B.50% C.60% D.20%
▼优质解答
答案和解析
B 解析:根据H2燃烧的热化学方程式,知当生成18 g水时,消耗H222.4 L,放出热量为285.8 kJ,则CO燃烧放出的热量为(710.0 kJ-285.8 kJ)=424.2 kJ,由CO燃烧的热化学方程式可计算出CO的体积为33.6 L,故CO的体积分数为50%。
看了 已知2H2(g)+O2(g)...的网友还看了以下:
在标准状况下,1L丙烷和2L乙烷的混合气体在80L空气中完全燃烧,生成的气体经干燥后,其体积为?为 2020-05-16 …
一道高中化学必修二的计算题有机物A在101.325KPA.227摄氏度时体积为2.6L,与同一状况 2020-05-16 …
请教一道有关有机物燃烧后体积计算的题1.01×10^5Pa、150℃时,将1L C2H4、2L C 2020-05-16 …
4.质量为m的炮弹飞出炮筒时的速度为v,炮筒长度为L,设火药爆炸后形成的气体压力恒定并不计筒壁阻力 2020-05-17 …
将在120摄氏度.1.01×10的5次方的条件下由烃A和烃B组成的2L混合气体.与足量的氧气混合并 2020-06-27 …
将在120℃、1.01×105Pa的条件下由烃A和烯烃B组成的2L混合气体,与足量的氧气混合并点燃 2020-06-27 …
常温下,16g某化合物X2H4在一定量的O2中恰好完全燃烧,生成11.2L(标准状况下)气体X2和 2020-07-13 …
已知1molCO气体完全燃烧生成CO2气体放出283KJ热量;1molH2完全燃烧生成液态水放出2 2020-07-19 …
将在120℃、1.01×105Pa的条件下由烃A和烯烃B组成的2L混合气体,与足量的氧气混合并点燃 2020-08-02 …
现取5.8g有机物A与11.2L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳,一氧化碳和水蒸 2020-12-28 …