早教吧作业答案频道 -->化学-->
氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法.I.电解处理法用图1所示装置处理含CN-废
题目详情
氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法.
I.电解处理法
用图1所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的
ClO-将CN-氧化为无害物质而除去.
(1)铁电极为___(填“阴极”或“阳极”),阳极产生ClO-的电极反应为___.
II.UV(紫外光线的简称)-H2O2氧化法.
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
(2)废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是___(用符号表示).
(3)K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应___.
(4)含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为___(a.7-10;b.10-11;c.11-13),解释选择该pH范围的原___.
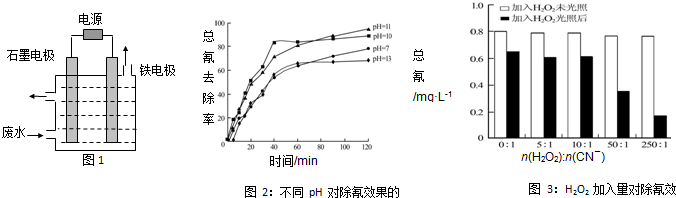
(5)图3表示某pH时,加入不同量H2O2,处理30min后测定的样品含氰浓度.由图可知:
n(H2O2):n(CN-)=250:1时,剩余总氰为0.16mg•L-1,除氰率达80%,计算0-30min时间段反应速率v(CN-)=___mg•L-1min-1(结果保留两位有效数字).
I.电解处理法
用图1所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的
ClO-将CN-氧化为无害物质而除去.
(1)铁电极为___(填“阴极”或“阳极”),阳极产生ClO-的电极反应为___.
II.UV(紫外光线的简称)-H2O2氧化法.
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
(2)废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是___(用符号表示).
(3)K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应___.
(4)含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为___(a.7-10;b.10-11;c.11-13),解释选择该pH范围的原___.

(5)图3表示某pH时,加入不同量H2O2,处理30min后测定的样品含氰浓度.由图可知:
n(H2O2):n(CN-)=250:1时,剩余总氰为0.16mg•L-1,除氰率达80%,计算0-30min时间段反应速率v(CN-)=___mg•L-1min-1(结果保留两位有效数字).
▼优质解答
答案和解析
(1)废水中含CN-,控制溶液pH为9~10并加入NaCl,阳极产生的ClO-将CN-氧化,说明溶液中的氯离子在阳极失去电子发生氧化反应,电极反应为:2OH-+Cl--2e-═ClO-+H2O,阴极是氢离子得电子产生氢气,铁是活性电极,在装置中只能作阴极,不参加反应,
故答案为:阴极;2OH-+Cl--2e-═ClO-+H2O;
(2)根据离子反应方程式CN-+H2O2+H2O═A+NH3↑可知,N化合价为-3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒,A应是带一个负电荷的阴离子,且包含1个C,1个H,3个O,即HCO3-,
故答案为:HCO3-;
(3)Fe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN-发生微弱水解,即[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-,
故答案为:[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-;
(4)图2显示,PH在10-11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒),
故答案为:碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒);
(5)剩余总氰为0.16mg•L-1,除氰率达80%,则氰的总量为:0.16mg•L-1÷(1-80%)=0.80mg•L-1,
0-30分钟氰的改变量为:△c(CN-)=0.80mg•L-1×80%=0.64mg•L-1,v(CN-)=
=
=0.021mg•L-1min-1,
故答案为:0.021.
故答案为:阴极;2OH-+Cl--2e-═ClO-+H2O;
(2)根据离子反应方程式CN-+H2O2+H2O═A+NH3↑可知,N化合价为-3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒,A应是带一个负电荷的阴离子,且包含1个C,1个H,3个O,即HCO3-,
故答案为:HCO3-;
(3)Fe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN-发生微弱水解,即[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-,
故答案为:[Fe(CN)6]3-+3H2O⇌Fe(OH)3+3HCN+3CN-;
(4)图2显示,PH在10-11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒),
故答案为:碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化;碱性太强,溶液中4[Fe(CN)6]3-+4OH-═4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去;碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒);
(5)剩余总氰为0.16mg•L-1,除氰率达80%,则氰的总量为:0.16mg•L-1÷(1-80%)=0.80mg•L-1,
0-30分钟氰的改变量为:△c(CN-)=0.80mg•L-1×80%=0.64mg•L-1,v(CN-)=
| △c(CN-) |
| △t |
| 0.64mg•L-1 |
| 30min |
故答案为:0.021.
看了 氰化物在冶金等行业应用广泛,...的网友还看了以下:
污水处理贷款是指用于新增污水处理厂建设、污水配套管网建设、污水处理处置和污水再生利用工程建设 2020-05-27 …
中央电视台《新闻调查》栏目2009年ll月21日播出的《垃圾焚烧之惑》聚焦报道了广东番禺垃圾焚烧发 2020-06-22 …
下图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是A.进入烟囱的气体为纯净物B.此过程中硫 2020-06-28 …
材料:“去产能”是中央经济工作会议确定的2016年五大结构性改革任务之首,而清理处置“僵尸企业”是 2020-07-08 …
氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3 2020-07-08 …
2015年,非洲发生埃博拉疫情.下列预防埃博拉病毒流行的措施中,属于控制传染源的是()A.医生照料患 2020-11-05 …
2005年4月1日,京沪高速公路上发生一起重大液氯泄漏事故.武警、消防人员迅速赶赴现场,他们利用石灰 2020-11-22 …
似的似乎相似的读音相同吗挑战单挑挑水传说流传传达处理处置相处哪些读音相同,哪些不相同 2020-12-12 …
英语词组:处理,处置;更善解人意; 2021-01-12 …
肺磨玻璃结节,合理处置会消失 2021-04-21 …