早教吧作业答案频道 -->化学-->
酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题化合物Zn(OH)2Fe(OH)2Fe(OH)3Ksp近似值10-1710-1710-39(1)酸性锌锰干电池的负
题目详情
酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
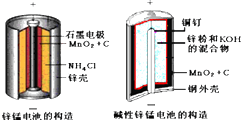
(1)酸性锌锰干电池的负极反应为___
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式___
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zn___g.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和___溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为___到___之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.

| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式___
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zn___g.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:
①加入足量稀硫酸和___溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为___到___之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.
▼优质解答
答案和解析
(1)酸性锌锰干电池的负极为锌,负极反应为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)在碱性锌锰原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O=MnOOH+OH-.故答案为:MnO2+e-+H2O=MnOOH+OH-;
(3)持电流强度为0.6A,电池工作10分钟,则电量为0.6A×600s=360C,转移电子的物质的量为
=0.00373mol,则消耗Zn的质量为0.00373mol×
×65g/mol=0.12g,
故答案为:0.12;
(4)①根据表格中的信息可知,Fe(OH)3沉淀的生成更容易,而Zn(OH)2和Fe(OH)2的沉淀同时发生.故要想除去锌中的铁杂质,应将铁转化为Fe3+,而铁和稀硫酸只能反应为Fe2+,故应加入氧化剂,故可以加入绿色的氧化剂双氧水,故答案为:双氧水;
②由于调节pH的目的是使Fe3+沉淀完全而Zn2+不沉淀.而
设Zn2+开始沉淀时所需的氢氧根的浓度为c(OH-),则有:0.1mol/L×c2(OH-)=10-17,解得c(OH-)=10-8mol/L,则c(H+)=10-6mol/L,pH=6.
设Fe3+沉淀完全时所需的氢氧根的浓度为c(OH-),由于当一种离子沉淀完全时即浓度小于等于10-5mol/L时,则有:10-5mol/L×c3(OH-)=10-39,解得c(OH-)=
mol/L≈0.5×10-11mol/L,此时pH=2.7.
故应调节pH在2.7到6之间.故答案为:2.7;6.
(2)在碱性锌锰原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O=MnOOH+OH-.故答案为:MnO2+e-+H2O=MnOOH+OH-;
(3)持电流强度为0.6A,电池工作10分钟,则电量为0.6A×600s=360C,转移电子的物质的量为
| 360C |
| 96500C/mol |
| 1 |
| 2 |
故答案为:0.12;
(4)①根据表格中的信息可知,Fe(OH)3沉淀的生成更容易,而Zn(OH)2和Fe(OH)2的沉淀同时发生.故要想除去锌中的铁杂质,应将铁转化为Fe3+,而铁和稀硫酸只能反应为Fe2+,故应加入氧化剂,故可以加入绿色的氧化剂双氧水,故答案为:双氧水;
②由于调节pH的目的是使Fe3+沉淀完全而Zn2+不沉淀.而
设Zn2+开始沉淀时所需的氢氧根的浓度为c(OH-),则有:0.1mol/L×c2(OH-)=10-17,解得c(OH-)=10-8mol/L,则c(H+)=10-6mol/L,pH=6.
设Fe3+沉淀完全时所需的氢氧根的浓度为c(OH-),由于当一种离子沉淀完全时即浓度小于等于10-5mol/L时,则有:10-5mol/L×c3(OH-)=10-39,解得c(OH-)=
| 3 | 10-34 |
故应调节pH在2.7到6之间.故答案为:2.7;6.
看了 酸性锌锰干电池和碱性锌锰干电...的网友还看了以下:
A、B、C三种元素电子层相同,B核电荷数比A多2,C质子数比B多4,1摩单质A与酸完全反应,生成1 2020-05-23 …
蓄电池的电动势为2v,干电池的电动势为1.5V,这表明A在相同的时间内蓄电池A在相同的时间内蓄电池 2020-06-03 …
近几天,电视台正在播放很多人认为精彩至极同问近几天,电视台正在播放一部精彩的电视连续剧.近几天,电 2020-06-15 …
两个相同的负电荷和一个正电荷附近的电场线分布如图所示,c是两负电荷连线的中点,d点在正电荷的正上方 2020-07-20 …
电动车轮子与速度有关吗?如果相同款式电动车的电池容量一样,只是轮子大小不一样,那么相同的路程,哪个会 2020-11-07 …
急,翻译英文.近年来,中国电影的票房收入实现了大步跨越.在2009年,我国电影产业的票房收入更是达到 2020-11-27 …
英语翻译2007年我国煤炭需求将保持平稳增长,增速可能会比2006年有小幅回升,2007年我国经济将 2020-11-27 …
有关电位比较器lm393的问题1电位比较器的最小误差是多少?比如两个比较电压最小能识别差值是多少?2 2020-11-28 …
两个电量分别为Q1=5×10-5C和Q2=3×10-5C形状相同的带电小球,.两个电量分别为Q1=5 2020-12-06 …
如图所示,绝缘细线悬挂着的两小球带同种电荷,将它们相互靠近,观察到两小球向两侧偏离的角度增大,由此可 2021-01-02 …