早教吧作业答案频道 -->化学-->
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).Ⅰ.查阅资料(1)Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
题目详情
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
Ⅰ.【查阅资料】
(1)Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4.
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸.
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):
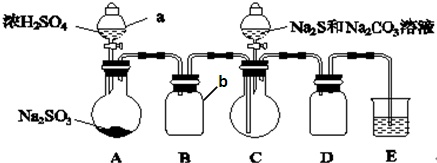
实验步骤:
(1)检查装置A、B气密性的方法是___,如图示加入试剂.仪器b的名称是___;E中的试剂是___(选填下列字母编号).
A.稀H2SO4
B.饱和Na2SO3溶液
C.饱和NaHSO3溶液
D.NaOH溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4.
(3)待Na2S和Na2CO3完全消耗后,结束反应.过滤C中的混合物,滤液经蒸发、结晶、过滤、___、干燥、得到产品.(填写操作名称)
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,___,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4.
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是___.
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过___方法提纯.
Ⅰ.【查阅资料】
(1)Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4.
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸.
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):

实验步骤:
(1)检查装置A、B气密性的方法是___,如图示加入试剂.仪器b的名称是___;E中的试剂是___(选填下列字母编号).
A.稀H2SO4
B.饱和Na2SO3溶液
C.饱和NaHSO3溶液
D.NaOH溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4.
(3)待Na2S和Na2CO3完全消耗后,结束反应.过滤C中的混合物,滤液经蒸发、结晶、过滤、___、干燥、得到产品.(填写操作名称)
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,___,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4.
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是___.
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过___方法提纯.
▼优质解答
答案和解析
浓硫酸和亚硫酸钠反应生成二氧化硫,用B装置收集二氧化硫,C中二氧化硫、硫化钠、碳酸钠反应生成硫代硫酸钠,D为安全瓶,防倒吸,二氧化硫有毒不能直接排空,用碱液吸收尾气,
Ⅱ.(1)利用压强差检验装置气密性,其检验方法为连接好装置,向C装置加水浸没长导管,在分液漏斗a中加适量水,打开分液漏斗活塞和上口瓶塞,分液漏斗中的水不向下流,说明装置A、B的气密性良好;
仪器b是安全瓶;E装置目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠、亚硫酸钠溶液反应,但亚硫酸钠吸收二氧化硫较慢,与稀H2SO4和饱和NaHSO3溶液不反应,所以E中试剂为氢氧化钠;
故答案为:连接好装置,向C装置加水浸没长导管,在分液漏斗a中加适量水,打开分液漏斗活塞和上口瓶塞,分液漏斗中的水不向下流,说明装置A、B的气密性良好;
安全瓶;D;
(3)从溶液中制取固体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥方法,故答案为:洗涤;
Ⅲ.(1)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,
故答案为:过滤,向沉淀中加入足量稀盐酸;
(2)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,防止Na2SO3被空气中的氧气氧化,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;防止Na2SO3被空气中的氧气氧化;
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,故答案为:重结晶.
Ⅱ.(1)利用压强差检验装置气密性,其检验方法为连接好装置,向C装置加水浸没长导管,在分液漏斗a中加适量水,打开分液漏斗活塞和上口瓶塞,分液漏斗中的水不向下流,说明装置A、B的气密性良好;
仪器b是安全瓶;E装置目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠、亚硫酸钠溶液反应,但亚硫酸钠吸收二氧化硫较慢,与稀H2SO4和饱和NaHSO3溶液不反应,所以E中试剂为氢氧化钠;
故答案为:连接好装置,向C装置加水浸没长导管,在分液漏斗a中加适量水,打开分液漏斗活塞和上口瓶塞,分液漏斗中的水不向下流,说明装置A、B的气密性良好;
安全瓶;D;
(3)从溶液中制取固体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥方法,故答案为:洗涤;
Ⅲ.(1)根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,
故答案为:过滤,向沉淀中加入足量稀盐酸;
(2)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,防止Na2SO3被空气中的氧气氧化,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;防止Na2SO3被空气中的氧气氧化;
(3)Na2S2O3•5H2O的溶解度随温度升高显著增大,所得产品通过重结晶方法提纯,故答案为:重结晶.
看了 硫代硫酸钠是一种重要的化工产...的网友还看了以下:
液体与固体具有的相同特点是()A.都具有确定的形状B.体积都不易被压缩C.物质分子的位置都确定D. 2020-05-13 …
(2010•徐汇区一模)下列关于固体、液体的说法中正确的是()A.液体容易被压缩,固体不易被压缩B 2020-05-13 …
维生素是维持人体正常新陈代谢所必需的物质.以下关于维生素的叙述错误的是()A.人体肝脏能将胡萝卜素 2020-06-18 …
对于某些数学问题,灵活运用整体思想,可以化难为易.在解二元一次方程组时,就可以运用整体代入法:如解 2020-08-01 …
含的无机盐是骨骼和牙齿的重要组成部分.儿童缺钙易患病,中老年人特别是妇女缺钙易患症.人体缺易患贫血 2020-08-02 …
人体器官的移植不易成活,根据现代免疫学分析,移植器官的组织细胞相当于()A.淋巴细胞B.疫苗C.抗体 2020-10-31 …
导体容易导电是由于()A.导体中存在大量的自由电子B.导体中存在大量的自由电荷C.导体中存在大导体容 2020-11-24 …
元素对人体健康有重要作用.下列说法错误的()A.人体缺铁易患贫血B.人体缺碘易患甲状腺肿大C.人体缺 2021-01-01 …
化学元素与人体健康有密切关系.下列说法不正确的是()A.人体缺钙--引起甲状腺肿大B.人体缺氟--易 2021-01-01 …
(2013•南安市质检)维生素是维持人体正常新陈代谢所必需的物质.以下关于维生素的叙述错误的是()A 2021-01-08 …