早教吧作业答案频道 -->化学-->
以煤为主要原料可以制备乙二醇,相关工艺流程如下:(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式(2)合成气在不同催化剂作用下,可以合成不同的物质.下列物质仅
题目详情
以煤为主要原料可以制备乙二醇,相关工艺流程如下:
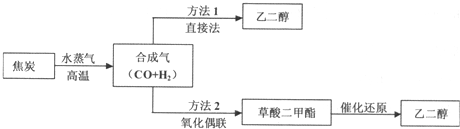
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式___
(2)合成气在不同催化剂作用下,可以合成不同的物质.下列物质仅用合成气为原料就能得到且原子利用率为100%的是___(填字母).
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH.)与C02反应制备合成气.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol
则CH4与CO2生成合成气的热化学方程式为___.
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:CH3OOC-COOCH3(g)+4H2(g)⇌HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___(填字母).
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC-COOCH3=2H2O⇌2CH3OH+HOOC-COOH
①草酸是二元弱酸,可以制备KHC2O4 (草酸氢钾),KHC2O4溶液呈酸性,用化学平衡原理解释:___.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性.下列关系一定不正确的是
___(填字母).
A.c(Na+)>c(K+)>c(C2O42-)>c(HC2O4-)
B.c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)
C.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的___(填“正”或“负”)级,负极反应式为___.

322
4222
222
22
42
2332223
3323
2424
24
++242-24-
+24-242-224
++24-242-

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式___
(2)合成气在不同催化剂作用下,可以合成不同的物质.下列物质仅用合成气为原料就能得到且原子利用率为100%的是___(填字母).
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH.)与C02反应制备合成气.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol
则CH4与CO2生成合成气的热化学方程式为___.
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:CH3OOC-COOCH3(g)+4H2(g)⇌HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___(填字母).
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC-COOCH3=2H2O⇌2CH3OH+HOOC-COOH
①草酸是二元弱酸,可以制备KHC2O4 (草酸氢钾),KHC2O4溶液呈酸性,用化学平衡原理解释:___.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性.下列关系一定不正确的是
___(填字母).
A.c(Na+)>c(K+)>c(C2O42-)>c(HC2O4-)
B.c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)
C.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的___(填“正”或“负”)级,负极反应式为___.

322
4222
222
22
42
2332223
3323
2424
24
++242-24-
+24-242-224
++24-242-
▼优质解答
答案和解析
(1)合成气的主要成分为CO和H22,在催化剂条件下合成乙二醇的反应:2CO+3H22
HOCH2CH2OH,故答案为:2CO+3H2
HOCH2CH2OH;
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
催化剂 催化剂 催化剂 催化剂 HOCH22CH22OH,故答案为:2CO+3H22
HOCH2CH2OH;
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
催化剂 催化剂 催化剂 催化剂 HOCH22CH22OH;
(2)根据质量守恒定律可知,合成气的主要成分为CO和H22,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH33OH) 可以由CO和H22按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH44(g)+2O22(g)═CO22(g)+2H22O(l)△H=-890.3kJ/mol ①
2H22(g)+O22(g)═2H22O(l)△H=-571.6kJ/mol ②
2CO(g)+O22(g)═2CO22(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-,电离显酸性;HC22O44--+H22O⇌H22C22O44+OH--,水解显碱性,而HHC22O44溶液显酸性,说明HC22O44--的电离大于其水解,故答案为:HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-;HC22O44--+H22O⇌H22C22O44+OH--,而HC22O44--的电离大于其水解.
②在一定的KHC22O44溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC22O44反应掉,则溶液中的溶质为:KHC22O44和K22C22O44和Na22C22O44,
A、由于加入的NaOH的量必须较少,将部分KHC22O44反应掉,故c(Na++)不可能大于c(K++),故A错误;
B、溶液中的K++和HC22O44--、H22C22O44和C22O442-2-均来自于KHC22O44,根据物料守恒可知:c(K++)=c(HC22O44--)+c(C22O442-2-)+c(H22C22O44),故B正确;
C、根据电荷守恒可知:c(K++)+c(Na++)=c(HC22O44--)+2c(C22O442-2-)+c(OH--),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO332-2-,电极方程式为:
HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O,故答案为:负,HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O;
| ||
| ||
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
| ||
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.
| ||
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
| ||
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.(2)根据质量守恒定律可知,合成气的主要成分为CO和H22,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH33OH) 可以由CO和H22按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH44(g)+2O22(g)═CO22(g)+2H22O(l)△H=-890.3kJ/mol ①
2H22(g)+O22(g)═2H22O(l)△H=-571.6kJ/mol ②
2CO(g)+O22(g)═2CO22(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-,电离显酸性;HC22O44--+H22O⇌H22C22O44+OH--,水解显碱性,而HHC22O44溶液显酸性,说明HC22O44--的电离大于其水解,故答案为:HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-;HC22O44--+H22O⇌H22C22O44+OH--,而HC22O44--的电离大于其水解.
②在一定的KHC22O44溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC22O44反应掉,则溶液中的溶质为:KHC22O44和K22C22O44和Na22C22O44,
A、由于加入的NaOH的量必须较少,将部分KHC22O44反应掉,故c(Na++)不可能大于c(K++),故A错误;
B、溶液中的K++和HC22O44--、H22C22O44和C22O442-2-均来自于KHC22O44,根据物料守恒可知:c(K++)=c(HC22O44--)+c(C22O442-2-)+c(H22C22O44),故B正确;
C、根据电荷守恒可知:c(K++)+c(Na++)=c(HC22O44--)+2c(C22O442-2-)+c(OH--),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO332-2-,电极方程式为:
HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O,故答案为:负,HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O;
看了 以煤为主要原料可以制备乙二醇...的网友还看了以下:
文学艺术对于反映人们的精神生活,展示人们的精神世界有独特的作用。中华文化中的文学艺术展现了中华民族 2020-05-17 …
某学校有甲种材料35kg,乙种材料29kg,制作A、B两种型号的工艺品,用料情况如下 利用这些材料 2020-05-17 …
打篮球是一种艺术吗?老师让写“学艺”的事,几个同学写了学习打蓝球但老师语文说“这不是一种艺术。”问 2020-07-23 …
文学艺术用一个英语单词怎么说?除了literatureandart这个 2020-08-03 …
根据情境写名句1.在写作文时,我们有时无从下笔,经过冥思苦想,突然间文思泉涌,真可谓.2.艺术节上, 2020-11-03 …
学艺心得画了几幅水彩画,老师让他写一篇学艺心得,该怎么写?最好简洁明了,或是在画展上,独特、童稚一点 2020-11-07 …
人教版六年级上册习作八作文一篇,要求写的好,才提高悬赏.写毛笔那类的才艺,要求把学艺过程和学后感受写 2020-11-15 …
“这是一种纯文学的写作手法。它借用虚构等艺术手法在作品中去尽政治谎言,道德谎言,商业谎言等谎言,客观 2020-11-23 …
根据意思写出相应的成语.(1)指房屋的华丽的彩绘装饰,常用来形容建筑物富丽堂皇()(2)指文章或艺术 2020-11-24 …
帮忙写一篇通讯稿,200字左右,急!!!请以一个记者的身份写:XX大学艺术系在XX老师带领下去XX一 2020-12-01 …