(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50 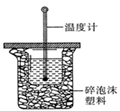 mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
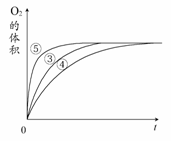
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50  mol/L 盐酸与50 mL
mol/L 盐酸与50 mL
0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。
实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
(1)中和热的测定是高中化学的定量实验之一.50 mL0.50  mol/L 盐酸与50 mL
mol/L 盐酸与50 mL

0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。从实验
装置上看,图中尚缺少的一种仪器是 。大烧杯上如不
盖硬纸板,求得的中和热数值将会
(填“偏大”、“偏小”或“无影响”)。
(2)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的
影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
实验编号
反应物
催化剂
①
10 mL 2% H2O2溶液
无
②
10 mL 5% H2O2溶液
无
③
10 mL 5% H2O2溶液
1 mL 0.1 mol·L-1FeCl3溶液
④
10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol·L-1FeCl3溶液
⑤
10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol·L-1FeCl3溶液
实验编号
反应物
催化剂
实验编号
实验编号
反应物
反应物
催化剂
催化剂
①
10 mL 2% H2O2溶液
无
①
①
10 mL 2% H2O2溶液
10 mL 2% H2O2溶液
无
无
②
10 mL 5% H2O2溶液
无
②
②
10 mL 5% H2O2溶液
10 mL 5% H2O2溶液
无
无
③
10 mL 5% H2O2溶液
1 mL 0.1 mol·L-1FeCl3溶液
③
③
10 mL 5% H2O2溶液
10 mL 5% H2O2溶液
1 mL 0.1 mol·L-1FeCl3溶液
1 mL 0.1 mol·L-1FeCl3溶液
④
10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol·L-1FeCl3溶液
④
④
10 mL 5% H2O2溶液+少量HCl溶液
10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol·L-1FeCl3溶液
1 mL 0.1 mol·L-1FeCl3溶液
⑤
10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol·L-1FeCl3溶液
⑤
⑤
10 mL 5% H2O2溶液+少量NaOH溶液
10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol·L-1FeCl3溶液
1 mL 0.1 mol·L-1FeCl3溶液
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条
件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法
 是 ________(填一种即可)。
是 ________(填一种即可)。

实验③④⑤中,测得生成氧气的体积随时间变化
的关系右图所示。
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2
分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
某同学通过测定O2的体积比较H2O2的分解速率快慢,实验时可以通过测量
________ 或 ________比较;
(2)0.1g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时
间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物
质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol/L的硫酸,10s时收集产生的H2体积为50 mL
(若折合成标准状况下的H2体积为44.8mL),用锌粒表示10s内该反应的速
率为______g/s;
根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法
不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高原料转化率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
比如实测直径7.7,长度505,实测重量0.187,然后每延米重量是0.371,是怎么算的呢如果是 2020-04-07 …
比如实测直径7.7,长度505,实测重量0.187,然后每延米重量是0.371,是怎么算的呢如果是 2020-04-07 …
为了探究某物质在固态和液态时的吸热能力,宗诚用酒精灯均匀加热0.4kg该种固体,根据实验数据绘制出 2020-06-12 …
测中和热的实验中,如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”为 2020-06-14 …
一个孔,φ4±0.2,位置度φ0.4ABC,在独立原则和最大实体原则两种情况下,检具插销尺寸怎么计 2020-06-26 …
党费收缴是阶梯收费吗?如实领工资是4000元,党费应该交4000*0.01=40元,还是3000* 2020-06-27 …
python实现6个数的排列组合,每个数可选值为0和1如题,实现(0,0,0,0,0,0),(0, 2020-07-17 …
下列情形时,如果a>0,抛物线y=a*x^2+b*x+c的顶点在顶点在什么?(1)方程a*x^2+ 2020-07-29 …
为了探究某物质在固态和液态时的吸热能力,宗诚用酒精灯均匀加热0.4kg该种固体,根据实验数据绘制出的 2020-11-05 …
如果热点偶热端为600度,冷端为30度,仪表的机械零点为0度,没有加以冷端温度补偿.问该仪表的指示值 2020-11-29 …