早教吧作业答案频道 -->化学-->
研究发现,NOx和SO2是雾霾的主要成分,已知:2CO(g)+O2(g)⇌CO2(g)△H1=-566.00kJ•mol-12SO2(g)+O2(g)⇌2SO3(g)△H2=-196.6kJ•mol-12NO(g)+O2(g)⇌2NO2(g)△H3=-113.0kJ•mol-1则反应2NO2(g)+
题目详情
研究发现,NOx和SO2是雾霾的主要成分,已知:
2CO(g)+O2(g)⇌CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)⇌2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)⇌SO3(g)+2NO(g)+CO2(g)的△H=___.NOx主要来源于汽车尾气.
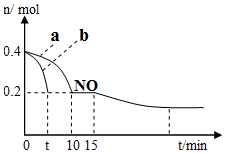
(1)T℃时,模拟汽车尾气催化转化:2NO+2CO⇌2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=___;平衡时若保持温度不变,再向容器中充入0.2mol CO和0,.4mol N2,平衡将___移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是___(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
回答下列问题:
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为___>___>___.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:___.
(3)已知NaHSO3溶液显酸性,下列说法正确的是___.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)研究发现,NOx和SO2是雾霾的主要成分,已知:
2CO(g)+O2(g)⇌CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)⇌2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)⇌SO3(g)+2NO(g)+CO2(g)的△H=___.NOx主要来源于汽车尾气.

(1)T℃时,模拟汽车尾气催化转化:2NO+2CO⇌2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=___;平衡时若保持温度不变,再向容器中充入0.2mol CO和0,.4mol N2,平衡将___移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是___(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
回答下列问题:
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为___>___>___.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:___.
(3)已知NaHSO3溶液显酸性,下列说法正确的是___.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)x2
221-1
2232-1
223-1
2232x

22
2
2
化学式 H2CO3 H2SO3 电离平衡常数 K1=4.30×10-7
K2=5.61×10-11 K1=1.54×10-2
K2=1.02×10-7 化学式 H2CO3 H2SO3 化学式 H2CO3 23H2SO3 23 电离平衡常数 K1=4.30×10-7
K2=5.61×10-11 K1=1.54×10-2
K2=1.02×10-7 电离平衡常数 K1=4.30×10-7
K2=5.61×10-11 1-7
2-11K1=1.54×10-2
K2=1.02×10-7 1-2
2-7
23323
23-
3
+)32-3-23
++─3─)32-
3-+2332-
+2332--
2CO(g)+O2(g)⇌CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)⇌2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)⇌SO3(g)+2NO(g)+CO2(g)的△H=___.NOx主要来源于汽车尾气.

(1)T℃时,模拟汽车尾气催化转化:2NO+2CO⇌2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=___;平衡时若保持温度不变,再向容器中充入0.2mol CO和0,.4mol N2,平衡将___移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是___(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为___>___>___.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:___.
(3)已知NaHSO3溶液显酸性,下列说法正确的是___.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)研究发现,NOx和SO2是雾霾的主要成分,已知:
2CO(g)+O2(g)⇌CO2(g)△H1=-566.00kJ•mol-1
2SO2(g)+O2(g)⇌2SO3(g)△H2=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H3=-113.0kJ•mol-1
则反应2NO2(g)+SO2(g)+CO(g)⇌SO3(g)+2NO(g)+CO2(g)的△H=___.NOx主要来源于汽车尾气.

(1)T℃时,模拟汽车尾气催化转化:2NO+2CO⇌2CO2+N2,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示:
①T℃时该化学反应的平衡常数K=___;平衡时若保持温度不变,再向容器中充入0.2mol CO和0,.4mol N2,平衡将___移动.(填“向左”、“向右”或“不”)
②图1中a、b分别表示使用同种催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是___(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___.
(二)SO2主要来源于煤的燃烧.
25℃时,电离平衡常数:
| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
(2)①常温下,pH相同的下列溶液:I、Na2CO3,II、NaHCO3,III、Na2SO3.物质的量浓度由大到小的排列顺序为___>___>___.(用序号表示)
②用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是:___.
(3)已知NaHSO3溶液显酸性,下列说法正确的是___.
A.c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
B.c(Na+)+c(H+)=c(OH─)+c(HSO3─)+c(SO32-)
C.c(HSO3-)>c(H+)>c(H2SO3)>c(SO32-)
D.c(H+)+c(H2SO3)=c(SO32-)+c(OH-)x2
221-1
2232-1
223-1
2232x

22
2
2
| 化学式 | H2CO3 | H2SO3 |
| 电离平衡常数 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
K2=5.61×10-11
K2=1.02×10-7
K2=5.61×10-11
K2=1.02×10-7
K2=5.61×10-11
2-11
K2=1.02×10-7
2-7
23323
23-
3
+)32-3-23
++─3─)32-
3-+2332-
+2332--
▼优质解答
答案和解析
①2CO(g)+O22(g)⇌CO22(g)△H11=-566.00kJ•mol-1-1
②2SO22(g)+O22(g)⇌2SO33(g)△H22=-196.6kJ•mol-1-1
③2NO(g)+O22(g)⇌2NO22(g)△H33=-113.0kJ•mol-1-1,
×①+
×②-③得,2NO2(g)+SO2(g)+CO(g)⇌SO3(g)+2NO(g)+CO2(g)△H=-268.3kJ•mol-1,
故答案为:-268.3kJ•mol-1;
(1)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO+2CO⇌2CO2+N2
起始(n):0.4 0.4 0 0
变化:0.2 0.2 0.2 0.1
平衡:0.2 0.2 0.2 0.1
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
k=
=
=5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
=
=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
1 2 1 1 12 2 2×①+
×②-③得,2NO2(g)+SO2(g)+CO(g)⇌SO3(g)+2NO(g)+CO2(g)△H=-268.3kJ•mol-1,
故答案为:-268.3kJ•mol-1;
(1)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO+2CO⇌2CO2+N2
起始(n):0.4 0.4 0 0
变化:0.2 0.2 0.2 0.1
平衡:0.2 0.2 0.2 0.1
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
k=
=
=5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
=
=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
1 2 1 1 12 2 2×②-③得,2NO22(g)+SO22(g)+CO(g)⇌SO33(g)+2NO(g)+CO22(g)△H=-268.3kJ•mol-1-1,
故答案为:-268.3kJ•mol-1-1;
(1)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO+2CO⇌2CO22+N22
起始(n):0.4 0.4 0 0
变化:0.2 0.2 0.2 0.1
平衡:0.2 0.2 0.2 0.1
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO22)=0.1mol/L,c(N22)=0.05mol/L,
k=
=
=5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
=
=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
c2(CO2)×c(N2) c2(NO)×c2(CO) c2(CO2)×c(N2) c2(CO2)×c(N2) c2(CO2)×c(N2)2(CO2)×c(N2)2)×c(N2)2)c2(NO)×c2(CO) c2(NO)×c2(CO) c2(NO)×c2(CO)2(NO)×c2(CO)2(CO)=
=5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
=
=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
0.12×0.05 0.12×0.12 0.12×0.05 0.12×0.05 0.12×0.052×0.050.12×0.12 0.12×0.12 0.12×0.122×0.122=5(mol/L)-1-1;
平衡时若保持温度不变,再向容器中充入CO、N22各0.8mol,则c(CO)=0.5mol/L,c(N22)=0.45mol/L,
Qc=
=
=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
c2(CO2)×c(N2) c2(NO)×c2(CO) c2(CO2)×c(N2) c2(CO2)×c(N2) c2(CO2)×c(N2)2(CO2)×c(N2)2)×c(N2)2)c2(NO)×c2(CO) c2(NO)×c2(CO) c2(NO)×c2(CO)2(NO)×c2(CO)2(CO)=
=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
0.12×0.45 0.12×0.52 0.12×0.45 0.12×0.45 0.12×0.452×0.450.12×0.52 0.12×0.52 0.12×0.522×0.522=1.8故答案为:5(mol/L)-1-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO33-->SO332-2->CO332-2-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO22反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H22O+2SO22+CO332-2-═2HSO33--+CO22↑;
故答案为:H22O+2SO22+CO332-2-═2HSO33--+CO22↑;
(3)A.由物料守恒得,c(Na++)=c(HSO33--)+c(SO332-2-)+c(H22SO33),故A错误;
B.根据电荷守恒得,c(Na++)+c(H++)=c(OH──)+c(HSO33──)+2c(SO332-2-),故B错误;
C.NaSCO33溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH--)>c(H++),说明HSO33--水解程度大于其电离程度,故c(Na++)>c(HSO33--)、c(H22SO33)>c(SO332-2-),水解程度不大所以c(HSO33--)>c(H22SO33)、c(HSO33--)>c(OH--),溶液中氢氧根来源于水的电离与HSO33--水解,故c(OH--)>c(H22SO33),所以c(Na++)>c(HSO33--)>c(OH--)>c(H22SO33)>c(SO332-2-),故C错误;
D.据物料守恒,c(Na++)=c(HSO33--)+c(SO332-2-)+c(H22SO33)①,根据电荷守恒,c(Na++)+c(H++)=c(OH──)+c(HSO33──)+2c(SO332-2-)②,由①②得c(H++)+c(H22SO33)=c(SO332-2-)+c(OH--),故D正确;
故答案为:D.
②2SO22(g)+O22(g)⇌2SO33(g)△H22=-196.6kJ•mol-1-1
③2NO(g)+O22(g)⇌2NO22(g)△H33=-113.0kJ•mol-1-1,
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-268.3kJ•mol-1;
(1)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO+2CO⇌2CO2+N2
起始(n):0.4 0.4 0 0
变化:0.2 0.2 0.2 0.1
平衡:0.2 0.2 0.2 0.1
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
k=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.05 |
| 0.12×0.12 |
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.45 |
| 0.12×0.52 |
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-268.3kJ•mol-1;
(1)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO+2CO⇌2CO2+N2
起始(n):0.4 0.4 0 0
变化:0.2 0.2 0.2 0.1
平衡:0.2 0.2 0.2 0.1
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
k=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.05 |
| 0.12×0.12 |
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.45 |
| 0.12×0.52 |
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
| 1 |
| 2 |
故答案为:-268.3kJ•mol-1-1;
(1)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO+2CO⇌2CO22+N22
起始(n):0.4 0.4 0 0
变化:0.2 0.2 0.2 0.1
平衡:0.2 0.2 0.2 0.1
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO22)=0.1mol/L,c(N22)=0.05mol/L,
k=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.05 |
| 0.12×0.12 |
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.45 |
| 0.12×0.52 |
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.05 |
| 0.12×0.12 |
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.45 |
| 0.12×0.52 |
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
| 0.12×0.05 |
| 0.12×0.12 |
平衡时若保持温度不变,再向容器中充入CO、N22各0.8mol,则c(CO)=0.5mol/L,c(N22)=0.45mol/L,
Qc=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.45 |
| 0.12×0.52 |
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.45 |
| 0.12×0.52 |
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO3->SO32->CO32-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(3)A.由物料守恒得,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.根据电荷守恒得,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-),故B错误;
C.NaSCO3溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH-)>c(H+),说明HSO3-水解程度大于其电离程度,故c(Na+)>c(HSO3-)、c(H2SO3)>c(SO32-),水解程度不大所以c(HSO3-)>c(H2SO3)、c(HSO3-)>c(OH-),溶液中氢氧根来源于水的电离与HSO3-水解,故c(OH-)>c(H2SO3),所以c(Na+)>c(HSO3-)>c(OH-)>c(H2SO3)>c(SO32-),故C错误;
D.据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3)①,根据电荷守恒,c(Na+)+c(H+)=c(OH─)+c(HSO3─)+2c(SO32-)②,由①②得c(H+)+c(H2SO3)=c(SO32-)+c(OH-),故D正确;
故答案为:D.
| 0.12×0.45 |
| 0.12×0.52 |
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(2)①从表格数据分析得酸性:HCO33-->SO332-2->CO332-2-,所以碳酸钠的水解程度大于亚硫酸钠,大于碳酸氢钠,则当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是II>III>I,
故答案为:II;III;I;
②碳酸钠溶液与SO22反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H22O+2SO22+CO332-2-═2HSO33--+CO22↑;
故答案为:H22O+2SO22+CO332-2-═2HSO33--+CO22↑;
(3)A.由物料守恒得,c(Na++)=c(HSO33--)+c(SO332-2-)+c(H22SO33),故A错误;
B.根据电荷守恒得,c(Na++)+c(H++)=c(OH──)+c(HSO33──)+2c(SO332-2-),故B错误;
C.NaSCO33溶液呈碱性,说明碳酸氢根离子的水解程度大于电离程度;c(OH--)>c(H++),说明HSO33--水解程度大于其电离程度,故c(Na++)>c(HSO33--)、c(H22SO33)>c(SO332-2-),水解程度不大所以c(HSO33--)>c(H22SO33)、c(HSO33--)>c(OH--),溶液中氢氧根来源于水的电离与HSO33--水解,故c(OH--)>c(H22SO33),所以c(Na++)>c(HSO33--)>c(OH--)>c(H22SO33)>c(SO332-2-),故C错误;
D.据物料守恒,c(Na++)=c(HSO33--)+c(SO332-2-)+c(H22SO33)①,根据电荷守恒,c(Na++)+c(H++)=c(OH──)+c(HSO33──)+2c(SO332-2-)②,由①②得c(H++)+c(H22SO33)=c(SO332-2-)+c(OH--),故D正确;
故答案为:D.
看了 研究发现,NOx和SO2是雾...的网友还看了以下:
在如图所示的几个实验,下列表达正确的是()A.图(a)研究电磁铁中磁性强弱与电流大小的关系B.图( 2020-05-14 …
下述情况中的物体,可视为质点的是()A.研究小孩沿滑梯下滑.B.研究地球自转运动的规律.C.研究手 2020-05-23 …
研磨孔时,有槽的研磨棒用于( )。A.精研磨B.粗研磨C.精研磨或粗研磨 2020-06-07 …
在研究下列问题时,能把物体看成质点的是()A.研究地球的公转B.研究蜜蜂翅膀的振动C.研究汽车轮胎 2020-07-04 …
c研究古地震的活动规律,需要知道古地震的发生年代.根据科学家的研究,发现古地震至今的间隔年代y与被 2020-07-24 …
某研究性学习小组做撍?奶寤?嫖露缺浠瘮的研究,得到如图所示的图像.从图中可知,水温度从8~C降到2 2020-07-28 …
已知函数y=x+a/x有如下性质:如果常数a>0,那么该函数在(0,√a]上是减函数,在[√a,+ 2020-08-01 …
下列情况的运动物体不能被看作质点的是()A.研究嫦娥2号绕月球飞行的轨迹B.研究飞行中直升飞机的螺旋 2020-11-12 …
(2013•南通模拟)科研人员研究了单侧光对水稻根生长的影响,得到图1、2所示的实验结果.相关叙述正 2020-11-21 …
读图,回答相关问题.(1)图中A、B、C都是世界上著名的航天研究中心,试写出三大航天城的名称.A,B 2020-11-25 …