早教吧作业答案频道 -->化学-->
肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气.已知:①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ•mol-1②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1(1)写出肼和N2O4反应反应生成N
题目详情
肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气.已知:
①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
(1)写出肼和N2O4反应反应生成N2和水蒸气的热化学方程式___;
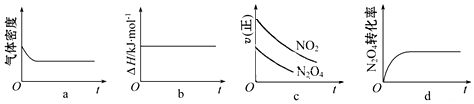
(2)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4(g)⇌2NO2(g)△H>0,一定温度下,将1mol N2O4充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___.
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时负极的电极反应式是___.
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是___.肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气.已知:
①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
(1)写出肼和N2O4反应反应生成N2和水蒸气的热化学方程式___;
(2)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4(g)⇌2NO2(g)△H>0,一定温度下,将1mol N2O4充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___.

(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时负极的电极反应式是___.
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是___.242
22241-1
242222-1
242
24224

3
①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
(1)写出肼和N2O4反应反应生成N2和水蒸气的热化学方程式___;
(2)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4(g)⇌2NO2(g)△H>0,一定温度下,将1mol N2O4充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___.

(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时负极的电极反应式是___.
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是___.肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气.已知:
①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
(1)写出肼和N2O4反应反应生成N2和水蒸气的热化学方程式___;
(2)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4(g)⇌2NO2(g)△H>0,一定温度下,将1mol N2O4充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___.

(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时负极的电极反应式是___.
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液.该反应的离子方程式是___.242
22241-1
242222-1
242
24224

3
▼优质解答
答案和解析
(1)肼可作为火箭发动机的燃料,与氧化剂N22O44反应生成N22和水蒸气,
①N22(g)+2O22(g)=N22O44(l)△H11=-19.5kJ•mol-1-1
②N22H44(l)+O22(g)=N22(g)+2H22O(g)△H22=-534.2kJ•mol-1-1
根据盖斯定律将方程式②×2-①得肼和N22H44 反应的热化学方程式:2N22H44(l)+N22O44(l)=3N22(g)+4H22O(g)△H=-1048.9kJ/mol,
故答案为:2N22H44(l)+N22O44(l)=3N22(g)+4H22O(g)△H=-1048.9kJ/mol;
(2)a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据图象,正反应速率还在减小,则说明未达到平衡状态,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故选ad;
(3)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N22H44+4OH---4e--=4H22O+N22↑,
故答案为:N22H44+4OH---4e--=4H22O+N22↑;
(4)NH33与NaClO发生氧化还原反应可得到肼(N22H44)、氯化钠和水,所以该反应的离子方程式为:2NH33+ClO--=N22H44+Cl--+H22O,
故答案为:2NH33+ClO--=N22H44+Cl--+H22O.
①N22(g)+2O22(g)=N22O44(l)△H11=-19.5kJ•mol-1-1
②N22H44(l)+O22(g)=N22(g)+2H22O(g)△H22=-534.2kJ•mol-1-1
根据盖斯定律将方程式②×2-①得肼和N22H44 反应的热化学方程式:2N22H44(l)+N22O44(l)=3N22(g)+4H22O(g)△H=-1048.9kJ/mol,
故答案为:2N22H44(l)+N22O44(l)=3N22(g)+4H22O(g)△H=-1048.9kJ/mol;
(2)a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据图象,正反应速率还在减小,则说明未达到平衡状态,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故选ad;
(3)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N22H44+4OH---4e--=4H22O+N22↑,
故答案为:N22H44+4OH---4e--=4H22O+N22↑;
(4)NH33与NaClO发生氧化还原反应可得到肼(N22H44)、氯化钠和水,所以该反应的离子方程式为:2NH33+ClO--=N22H44+Cl--+H22O,
故答案为:2NH33+ClO--=N22H44+Cl--+H22O.
看了 肼可作为火箭发动机的燃料,与...的网友还看了以下:
2010年8月10日6时49分,中国在太原卫星发射中心用“长征四号丙”运载火箭,成功地将“遥感卫星十 2020-11-11 …
在射箭运动中,弓对箭的力可以使箭由静止变为运动,箭在飞行过程中没有做直线运动的原因是.(不计空气阻力 2020-11-22 …
自制水滴显微镜的过程通常分为两个步骤:步骤一:首先通过水滴(相当于凸透镜)观察下方的黑色箭头(如图a 2020-11-24 …
运载火箭完成任务后如何处理就是说,火箭成功把卫星运送至既定轨道后,火箭怎样处理,是回收,还是设计它直 2020-12-15 …
如图所示,我国在西昌卫星发射中心用“长征三号乙”运载火箭,成功将“中星9号”广播电视直播卫星送入太空 2020-12-15 …
2012年4月30日4时50分,我国在西昌卫星发射中心用“长征三号乙”运载火箭,成功发射两颗北斗导航 2020-12-15 …
2013年10月25日,我国在酒泉卫星发射中心用长征四号乙运载火箭,成功将实践十六号卫星发射升空.这 2020-12-15 …
2011年4月10日,我国在西昌卫星发射中心用“长征三号甲”运载火箭,成功发射了第八颗北斗导航卫星. 2020-12-15 …
(2012•湖北模拟)2012年4月30日4时50分,我国在西昌卫星发射中心用“长征三号乙”运载火箭 2020-12-16 …
2011年4月10日4时47分,我国在西昌卫星发射中心用“长征三号甲”运载火箭,成功将第颗北斗导航卫 2021-01-12 …