早教吧作业答案频道 -->化学-->
一氧化碳是一种用途十分广泛的化工基础原料.(1)在高温下一氧化碳可将二氧化硫还原为单质硫.乙知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/molCO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
题目详情
一氧化碳是一种用途十分广泛的化工基础原料.
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.
乙知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
则CO还原SO2生成CO2(g)和S(s)的热化学方程为___.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)⇌CH3OH(g).在不同温度下的化学平衡常数(K)如表:
①某温度下,将2molCO(g)和6molH2(g)充入2L的密闭容器中,充分反应后,达到平衡时c(CO)=0.5mol/L,则CO(g)的转化率为___,此时的温度为___.
②在恒容条件下,要提高CO(g)的转化率,呵以采取的措施有___(填字母序号).
A.升高温度 B.加入催化剂 C.增加CO(g)的浓度D.充入H2(g)加压 E.分离出甲醇 F.充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是___.
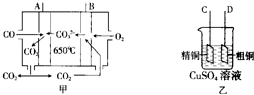
(3)如图图甲是一碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请问答下列问题:
①A极的电极反应式为___.
②进行粗铜精炼实验时,B极应该与___极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下)CO时,粗铜电极理论上减少铜的质量___(填“大于”“等于”或“小于”)6.4克.

(1)在高温下一氧化碳可将二氧化硫还原为单质硫.
乙知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
则CO还原SO2生成CO2(g)和S(s)的热化学方程为___.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)⇌CH3OH(g).在不同温度下的化学平衡常数(K)如表:
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.250 | 0.012 |
②在恒容条件下,要提高CO(g)的转化率,呵以采取的措施有___(填字母序号).
A.升高温度 B.加入催化剂 C.增加CO(g)的浓度D.充入H2(g)加压 E.分离出甲醇 F.充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是___.
(3)如图图甲是一碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请问答下列问题:
①A极的电极反应式为___.
②进行粗铜精炼实验时,B极应该与___极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下)CO时,粗铜电极理论上减少铜的质量___(填“大于”“等于”或“小于”)6.4克.
▼优质解答
答案和解析
(1)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
根据盖斯定律,①-②-③得到反应的热化学方程式为::
2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3=-270 kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1;
(2)①某温度下,将2molCO(g)和6molH2(g)充入2L的密闭容器中,充分反应后,达到平衡时c(CO)=0.5mol/L,
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始浓度(mol/L) 1 3 0 0
转化浓度(mol/L) 0.5 0.5 0.5 0.5
转化浓度(mol/L) 0.5 2.5 0.5 0.5
所以CO的转化率α(CO)=
×100%=50%
K=
=
=0.2,
反应的温度接近于300°C;
故答案为:50%;300°C;
②CO(g)+2H2(g)⇌CH3OH(g),依据平衡常数随温度变化可知,温度升高,平衡常数减小说明反应是放热反应,在恒容条件下,要提高CO(g)的转化率,可以改变条件使平衡正向进行;
A.升高温度,平衡向逆反应移动,平衡时CO的转化率减小,故A错误;
B.加入催化剂,缩短到达平衡时间,平衡不移动,CO转化率不变,故B错误;
C.增加CO的浓度,平衡向正反应移动,平衡时CO的转化率减小,故C错误;
D.加入H2加压,平衡向正反应移动,平衡时CO的转化率增大,故D正确;
E.分离出甲醇,平衡向正反应移动,平衡时CO的转化率增大,故E正确.
F.加入惰性气体加压,反应混合物的浓度不变,变化不移动,故F错误;
故选:DE;
③生产过程中,合成气要进行循环,这样可以提高原料利用率,符合经济效益;
故答案为:提高原料利用率;.
(3)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D;
故答案为:D.
③当消耗标准状况下2.24L CO时,电极反应式:CO-2e-+CO32-=2CO2,失去电子为
×2=0.2mol,精铜电极电极反应式:Cu2++2e-=Cu,由电子得失守恒可知Cu2+的物质的量为0.1mol,精铜电极的质量增加的质量为:0.1mol×64g/mol=6.4g,粗铜做阳极,其中的铜、锌、镍等金属失电子,粗铜电极理论上减少铜的质量一定小于6.4g;
故答案:小于6.4g.
②CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
根据盖斯定律,①-②-③得到反应的热化学方程式为::
2CO(g)+SO2(g)=S(s)+2CO2(g)△H=△H1-△H2-△H3=-270 kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1;
(2)①某温度下,将2molCO(g)和6molH2(g)充入2L的密闭容器中,充分反应后,达到平衡时c(CO)=0.5mol/L,
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始浓度(mol/L) 1 3 0 0
转化浓度(mol/L) 0.5 0.5 0.5 0.5
转化浓度(mol/L) 0.5 2.5 0.5 0.5
所以CO的转化率α(CO)=
| 0.5mol/L |
| 1mol/L |
K=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| 0.5×0.5 |
| 0.5×2.5 |
反应的温度接近于300°C;
故答案为:50%;300°C;
②CO(g)+2H2(g)⇌CH3OH(g),依据平衡常数随温度变化可知,温度升高,平衡常数减小说明反应是放热反应,在恒容条件下,要提高CO(g)的转化率,可以改变条件使平衡正向进行;
A.升高温度,平衡向逆反应移动,平衡时CO的转化率减小,故A错误;
B.加入催化剂,缩短到达平衡时间,平衡不移动,CO转化率不变,故B错误;
C.增加CO的浓度,平衡向正反应移动,平衡时CO的转化率减小,故C错误;
D.加入H2加压,平衡向正反应移动,平衡时CO的转化率增大,故D正确;
E.分离出甲醇,平衡向正反应移动,平衡时CO的转化率增大,故E正确.
F.加入惰性气体加压,反应混合物的浓度不变,变化不移动,故F错误;
故选:DE;
③生产过程中,合成气要进行循环,这样可以提高原料利用率,符合经济效益;
故答案为:提高原料利用率;.
(3)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D;
故答案为:D.
③当消耗标准状况下2.24L CO时,电极反应式:CO-2e-+CO32-=2CO2,失去电子为
| 2.24L |
| 22.4L/mol |
故答案:小于6.4g.
看了一氧化碳是一种用途十分广泛的化...的网友还看了以下:
下列推论正确的是()A.由“HF比HCl稳定性好”,可推知HF比HCl沸点高B.由“同温度下等浓度 2020-05-17 …
求以下题目的详解1、有一种长方形小纸板,长为199毫米,宽为111毫米.现在用同样大小的这种小纸板 2020-05-17 …
一定条件下,16gA和22gB恰好反应生成C和2.5gD.在相同条件下,8gA和15gB反应生成D 2020-05-17 …
我国古代数学名著《九章算术》有“米谷粒分”题:粮仓开仓收粮,有人送来米1558石,验得米内夹谷,抽 2020-07-18 …
(a+b+c)除以3+X=212(a+b+d)除以3+X=200(a+c+d)除以3+X=172( 2020-07-18 …
一定条件下,16gA和22gB恰好反应生成C和4.5gD.在相同条件下,8gA和15gB反应可生成D 2020-11-27 …
在一定条件下,16gA和22gB恰好完全反应生成C和4.5gD.在相同条件下,8gA和15gB反应可 2020-11-27 …
在一定条件下,16gA和22gB恰好完全反应生成C和4.5gD.在相同条件下,8gA和15gB反应可 2020-11-27 …
在一定条件下,16克A和22克B恰好反应生成C和4.5克D,在相同条件下,8克A和足量的B反应生成D 2020-11-27 …
在一定条件下,16克A和22克B恰好生成C和4.5克D.在相同条件下,8克A和足量的B反应生成D和0 2020-11-27 …