实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到﹣3价.某同学取一定量的铁铝合金与一定量很稀的硝酸充分反
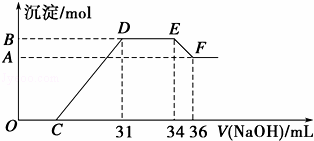
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到﹣3价.某同学取一定量的铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L ﹣1 的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)请写出该合金中铁与硝酸反应的离子方程式 .
(2)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 .
(3)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 .
(4)B与A的差值为 mol.
(5)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
考点:
离子方程式的有关计算.
分析:
铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有: ①H++OH﹣=H2O, ②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓, ③NH4++OH﹣═NH3•H2O, ④Al(OH)3 +OH﹣=AlO2﹣+2H2O. (1)金属铁和稀硝酸反应生成硝酸铁、一氧化氮和水,据此回答; (2)O→C 之间没有沉淀生成,说明硝酸过量,O→C之间发生的反应酸碱中和反应; (3)D与E一段沉淀的量没有发生变化,为NH4NO3和NaOH反应; (4)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,利用发生的化学反应来计算; (5)沉淀的总量可根据NH4+的量,根据NH4++OH﹣═NH3•H2O 得出n(NH4+),根据氧化还原反应,N元素由+5价变为﹣3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量.
铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有: ①H++OH﹣=H2O, ②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓, ③NH4++OH﹣═NH3•H2O, ④Al(OH)3 +OH﹣=AlO2﹣+2H2O (1)根据图示得到的溶液和氢氧化钠反应产生沉淀的情况可以知道,金属铁和稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:8Fe+30H++3NO3﹣=8Fe3++3NH4++9H2O,故答案为:8Fe+30H++3NO3﹣=8Fe3++3NH4++9H2O; (2)OC之间没有沉淀生成,说明硝酸过量,OC之间发生的反应酸碱中和反应,离子方程式为H++OH﹣═H2O,故答案为:H++OH﹣═H2O; (3)DE一段沉淀的量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为NH4++OH﹣═NH3•H2O,故答案为:NH4++OH﹣═NH3•H2O; (4)由图可知,EF段消耗的氢氧化钠溶液为36mL﹣34m=2mL,故该计算参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH﹣=AlO2﹣+2H2O可知,Al(OH)3的物质的量为0.008mol,即为B、A的差值,故答案为:0.008; (5)图中OC段没有沉淀生成,此阶段发生的离子方程式为H++OH﹣=H2O;在DE段沉淀的物质的量没有变化,应为NH4+和OH﹣的反应,此阶段发生反应的离子方程式为NH4++OH﹣═NH3•H2O;根据NH4++OH﹣═NH3•H2O 得:n(NH4+)=(34﹣31)×10﹣3L×4mol/L=0.012 mol,根据氧化还原反应,N元素由+5价变为﹣3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量为:=0.032mol,所以生成沉淀的物质的量为0.032mol, 设Mg为xmol,Al为0.008mol,生成硝酸铵为(34﹣31)×0.001L×4mol/L=0.012mol, 由电子守恒可知,2x+0.008×3=0.012×8, 解得x=0.036mol, 滴加NaOH体积为31ml时, 发生反应为①H++OH﹣=H2O,②Mg2++2OH﹣=Mg(OH)2↓,Al3++3OH﹣=Al(OH)3↓, 则C点氢氧化钠溶液的体积为31mL﹣×1000mL﹣×1000L=7mL, 故答案为:0.032;7.
点评:
本题考查金属与硝酸的反应、氧化还原反应、化学计算等知识点,属于中等难度试题,解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用.
某铁的氧化物5.8g,加热时用h2充分还原,剩余固体质量为4.2 g,则此铁的氧化物的化学式为() 2020-06-27 …
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2 2020-07-22 …
是不是磁铁只能吸引具有磁性的物质磁铁不能吸引不具有磁性的物质对吗?如果能被磁铁吸引那么这磁铁就一定可 2020-11-01 …
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2S 2020-12-16 …
下列关于人和动物关系的说法中,不正确的是()A.我们吃的很多食物来自于动物B.某些动物可为人类提供极 2020-12-22 …
科学家根据各个地层中的化石,可以推断出某种生物生存的年代,以及当时的自然环境.在越古老的地层里,成为 2021-01-01 …
科学家根据各个地层中的化石,可以推断出某种生物生存的年代,以及当时的自然环境。在越古老的地层里,成为 2021-01-01 …
1、某矿石所含有用矿物为磁铁矿、黄铁矿和磁黄铁kuang1、某矿石所含有用矿物为磁铁矿、黄铁矿和磁黄 2021-01-01 …
铁有多种氧化物,根据下列信息推断它们的化学式:(1)某铁的氧化物中铁元素的化合价为+3价,氧元素的化 2021-01-22 …
铁有多种氧化物,根据下列信息推断它们的化学式:(1)某铁的氧化物中铁元素的化合价为+3价,氧元素的化 2021-01-22 …