早教吧作业答案频道 -->化学-->
碳及其化合物在生活、化工领域发挥着重要的作用.试回答下列问题:(1)二甲醚(CH30CH3)是无色气体,可作为一种新型能源.工业上可用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g)⇌CH3OCH3
题目详情
碳及其化合物在生活、化工领域发挥着重要的作用.试回答下列问题:
(1)二甲醚(CH30CH3)是无色气体,可作为一种新型能源.工业上可用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H0
已知:
CO2(g)+3H2(g)⇌CH3OCH3(g)+H2O(g)△H1=-53.7kJ•mol-1
CH3OCH3(g)+H2O(g)⇌2CH3OH(g)△H2=+23.4kJ•mol-1
①合成二甲醚的△H=___
②下列能判断恒温恒容条件下合成二甲醚的反应已达到平衡的依据为___(填字母).
a.气体密度不变
b.压强不变
c.气体平均相对分子质量不变
d.反应前n(C02)=2mol,n(H2)=6mol,一段时间后测得容器中
的比值不变
③上述合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图1所示.T1温度下,将6mol CO2和12mol H2充人2L的恒容密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速v(CH3OCH3)=___;A、B、C三点对应平衡常数KA、KB.KC之间的大小关系为___.
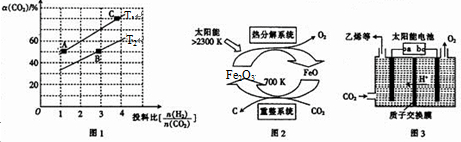
(2)有科学家提出由CO2制取C的太阳能工艺如图2所示,若重整系统发生的反应中
=4,则重整系统中发生反应的化学方程式为___
(3)以CO2为原料利用电解法可制取乙烯,其装置如图3所示.电极a为电源的___(填“正极”或“负极”),生成乙烯的电极反应式为___.
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液.反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=___.(已知常温下NH3•H2O的电离平衡常数 Kb=2×l0-5,H2CO3的电离平衡常数K1=4×l0-7)
(1)二甲醚(CH30CH3)是无色气体,可作为一种新型能源.工业上可用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H0
已知:
CO2(g)+3H2(g)⇌CH3OCH3(g)+H2O(g)△H1=-53.7kJ•mol-1
CH3OCH3(g)+H2O(g)⇌2CH3OH(g)△H2=+23.4kJ•mol-1
①合成二甲醚的△H=___
②下列能判断恒温恒容条件下合成二甲醚的反应已达到平衡的依据为___(填字母).
a.气体密度不变
b.压强不变
c.气体平均相对分子质量不变
d.反应前n(C02)=2mol,n(H2)=6mol,一段时间后测得容器中
| n(CO2) |
| n(H2) |
③上述合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图1所示.T1温度下,将6mol CO2和12mol H2充人2L的恒容密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速v(CH3OCH3)=___;A、B、C三点对应平衡常数KA、KB.KC之间的大小关系为___.

(2)有科学家提出由CO2制取C的太阳能工艺如图2所示,若重整系统发生的反应中
| n(FeO) |
| n(CO2) |
(3)以CO2为原料利用电解法可制取乙烯,其装置如图3所示.电极a为电源的___(填“正极”或“负极”),生成乙烯的电极反应式为___.
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液.反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=___.(已知常温下NH3•H2O的电离平衡常数 Kb=2×l0-5,H2CO3的电离平衡常数K1=4×l0-7)
▼优质解答
答案和解析
(1)①已知反应:ⅠCO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1 I
ⅡCH3OCH3(g)+H2O(g)⇌2CH3OH(g)△H2=+23.4kJ.mol-1 II
将I×2-II可得:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O (g)△H=(-53.7kJ.mol-1)×2-(+23.4kJ.mol-1)=-130.8 kJ.mol-1,
故答案为:-130.8 kJ.mol-1;
②对于反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O (g)
a.由于是恒容的容器,容器体积V一直不变,而此反应全部是气体参加和生成,故气体的质量一直不变,则气体的密度无论反应有没有达到平衡都一直不变,故不能作为反应达平衡的标志,故a错误;
b.由于容器恒容,而此反应正反应方向是气体的物质的量减小的反应,故反应在平衡之前,容器内的压强在变小,故当压强不变时,说明反应达平衡,故b正确;
c.此反应全部是气体参加和生成,故气体的质量一直不变,而正反应方向是气体的物质的量减小的反应,故平衡之前,气体平均相对分子质量在变大,故当不变时,能说明反应达平衡,故c正确;
d.反应前n(C02)=2mol,n(H2)=6mol,而根据物质的量的该变量等于计量数之比可知,△(C02):△(H2)=2:6,故无论反应是否达到平衡,n(C02):n(H2)恒等于2:6即1:3,故当比值不变时,不能说明反应达平衡,故d错误;
故答案为:bc;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×
=1.8mol,所以平均反应速率v(CH3OCH3)=
=0.18 mol/(L•min);
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度故T2温度大,则KA=KC>KB,
故答案为:0.18 mol/(L•min);KA=KC>KB;
(2)由CO2制取C的太阳能工艺图示可知,CO2被FeO还原为C,则FeO将被氧化,根据重整系统发生的反应中
=4,结合得失电子数守恒和质量守恒可知反应为:4FeO+CO2
C+2Fe2O3,故答案为:4FeO+CO2
C+2Fe2O3;
(3)电极a上通入CO2,生成C2H4,碳元素发生了还原反应,故电极a为阴极,则所连的是电源的负极;此电极上通入CO2,生成C2H4,碳元素的化合价由+4价变为-2价,结合溶液呈酸性可知极方程式为:2CO2+12e-+12H+=C2H4+4H2O,故答案为:负极;2CO2+12e-+12H+=C2H4+4H2O;
(4)反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=
,而NH3•H2O的电离平衡常数表达式Kb=
,H2C03的电离平衡常数K1=
,从而可得出平衡常数间的关系K=
ⅡCH3OCH3(g)+H2O(g)⇌2CH3OH(g)△H2=+23.4kJ.mol-1 II
将I×2-II可得:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O (g)△H=(-53.7kJ.mol-1)×2-(+23.4kJ.mol-1)=-130.8 kJ.mol-1,
故答案为:-130.8 kJ.mol-1;
②对于反应:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O (g)
a.由于是恒容的容器,容器体积V一直不变,而此反应全部是气体参加和生成,故气体的质量一直不变,则气体的密度无论反应有没有达到平衡都一直不变,故不能作为反应达平衡的标志,故a错误;
b.由于容器恒容,而此反应正反应方向是气体的物质的量减小的反应,故反应在平衡之前,容器内的压强在变小,故当压强不变时,说明反应达平衡,故b正确;
c.此反应全部是气体参加和生成,故气体的质量一直不变,而正反应方向是气体的物质的量减小的反应,故平衡之前,气体平均相对分子质量在变大,故当不变时,能说明反应达平衡,故c正确;
d.反应前n(C02)=2mol,n(H2)=6mol,而根据物质的量的该变量等于计量数之比可知,△(C02):△(H2)=2:6,故无论反应是否达到平衡,n(C02):n(H2)恒等于2:6即1:3,故当比值不变时,不能说明反应达平衡,故d错误;
故答案为:bc;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×
| 1 |
| 2 |
| ||
| 5min |
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度故T2温度大,则KA=KC>KB,
故答案为:0.18 mol/(L•min);KA=KC>KB;
(2)由CO2制取C的太阳能工艺图示可知,CO2被FeO还原为C,则FeO将被氧化,根据重整系统发生的反应中
| n(FeO) |
| n(CO2) |
| ||
| ||
(3)电极a上通入CO2,生成C2H4,碳元素发生了还原反应,故电极a为阴极,则所连的是电源的负极;此电极上通入CO2,生成C2H4,碳元素的化合价由+4价变为-2价,结合溶液呈酸性可知极方程式为:2CO2+12e-+12H+=C2H4+4H2O,故答案为:负极;2CO2+12e-+12H+=C2H4+4H2O;
(4)反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=
| c(NH3•H2O)•c(H2CO3) |
| c(NH4+)•c(HCO3-) |
| c(NH4+)•c(OH-) |
| c(NH3•H2O) |
| c(HCO3-)•c(H+) |
| c(H2CO3) |
| Kw |
看了碳及其化合物在生活、化工领域发...的网友还看了以下:
设函数f(x)在x=a的某个邻域内有定义,则f(x)在x=a处可导的一个充分条件是?请写出分析过程! 2020-03-30 …
如图,A,B,C,H四个小朋友在草坪上游戏,根据游戏规则,A,B,C三人围成一个三角形,B,H,C 2020-06-12 …
A~F为初中化学常见物质,这六种物质间存在图所示的关系(“→”表示转化关系,“-”表示反应关系). 2020-06-23 …
如何做等边三角形在H和V面上的投影一直ABC的点C在H面上 2020-08-02 …
下列有关生态工程的描述,错误的是()A.超载放牧导致草地退化,主要违背了协调与平衡原理B.我国南方水 2020-11-04 …
下列有关生态工程的描述,错误的是()A.生态工程是一类少消耗、多效益、可持续的工程体系B.我国南方地 2020-11-05 …
厂长(经理)是企业的法定代表人。这就是说,厂长(经理)A.就是企业法人B.在企业中处于中心地位,全面 2020-11-06 …
如图,A,B,C,H四个小朋友在草坪上游戏,根据游戏规则,A,B,C三人围成一个三角形,B,H,C三 2020-11-21 …
H2O2在工业、农业、医药上都有广泛的用途.(1)H2O2是二元弱酸,写出第一步的电离方程式,第二步 2020-12-14 …
H2O2在工业、农业、医药上都有广泛的用途.(1)H2O2是二元弱酸,写出第一步的电离方程式H2O2 2020-12-22 …
 扫描下载二维码
扫描下载二维码
