早教吧作业答案频道 -->化学-->
研究CO、CO2的应用具有重要的意义.(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1则CO还原Fe2O3(s)的热化学方程式
题目详情
研究CO、CO2的应用具有重要的意义.
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为___.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);
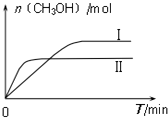
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H___ 0,曲线 I、II对应的平衡常数KI___KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为___.
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是___.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式___.根据化学反应原理,分析增加压强对制备二甲醚反应的影响___.

(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为___.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H___ 0,曲线 I、II对应的平衡常数KI___KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是___.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式___.根据化学反应原理,分析增加压强对制备二甲醚反应的影响___.
▼优质解答
答案和解析
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H<0,根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,而该反应为放热反应,所以升高温度平衡逆向移动,平衡常数变小,即KⅠ>KⅡ,
故答案为:<;>;
②设二氧化碳反应量为x
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
初始量(mol):1 3 0 0
转化量(mol):x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)/4=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4③CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);
a.反应前后气体物质的量变化,当容器中压强不变,说明反应达到平衡状态,故a正确;
b.H2的体积分数不变是平衡标志,故b正确;
c.速率之比等于化学方程式计量数之比为正反应速率之比,c(H2)=3c(CH3OH),不能说明正逆反应速率相同,不能证明反应达到平衡状态,故c错误;
d.反应前后气体质量不变,体积不变,容器中密度始终不变,不能说明反应达到平衡状态,故d错误;
e.2个C=O断裂的同时有3个C-H形成只能说明反应正向进行,不能说明反应达到平衡状态,故d错误;
故答案为:a b;
(3)二甲醚与空气可设计成燃料电池,若电解质为碱性,二甲醚在原电池负极失电子发生氧化反应生成碳酸盐,结合电荷守恒和原子守恒书写电极反应为:CH3OCH3-12 e-+16OH-═2CO32-+11 H2O,反应(g)+4H2(g)⇌CH3OCH3(g)+H2O(g).反应前后气体体积减小,增加压强平衡正向进行,该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
故答案为:CH3OCH3-12 e-+16OH-═2CO32-+11 H2O;该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H<0,根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,而该反应为放热反应,所以升高温度平衡逆向移动,平衡常数变小,即KⅠ>KⅡ,
故答案为:<;>;
②设二氧化碳反应量为x
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
初始量(mol):1 3 0 0
转化量(mol):x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)/4=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4
a.反应前后气体物质的量变化,当容器中压强不变,说明反应达到平衡状态,故a正确;
b.H2的体积分数不变是平衡标志,故b正确;
c.速率之比等于化学方程式计量数之比为正反应速率之比,c(H2)=3c(CH3OH),不能说明正逆反应速率相同,不能证明反应达到平衡状态,故c错误;
d.反应前后气体质量不变,体积不变,容器中密度始终不变,不能说明反应达到平衡状态,故d错误;
e.2个C=O断裂的同时有3个C-H形成只能说明反应正向进行,不能说明反应达到平衡状态,故d错误;
故答案为:a b;
(3)二甲醚与空气可设计成燃料电池,若电解质为碱性,二甲醚在原电池负极失电子发生氧化反应生成碳酸盐,结合电荷守恒和原子守恒书写电极反应为:CH3OCH3-12 e-+16OH-═2CO32-+11 H2O,反应(g)+4H2(g)⇌CH3OCH3(g)+H2O(g).反应前后气体体积减小,增加压强平衡正向进行,该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
故答案为:CH3OCH3-12 e-+16OH-═2CO32-+11 H2O;该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
看了研究CO、CO2的应用具有重要...的网友还看了以下:
连字成词(英语)l u o e b s r u s r e t o s w a e s r t e 2020-05-14 …
按字母拼单词1、M-F-R-R-E-A2、V-T-E-S3、O-S-E-M-U4、S-L-U-E- 2020-05-16 …
(2014•高邮市模拟)如图,已知AB是⊙O的直径,弦CD⊥AB于点E,点M在⊙O上,∠M=∠D. 2020-06-13 …
一个n脚输入的或门是否能被n-1个二脚输入的或门替代,为什么?顺便问个布尔代数化简M.R.P+Q. 2020-06-20 …
已知圆M的方程为:x²+y²-2x-2y-6=0,以坐标原点为圆心的圆O与圆M相切已知圆M的方程为 2020-06-27 …
(2008•徐汇区二模)如图所示,⊙O的半径OA=1,点M是线段OA延长线上的任意一点,⊙M与⊙O 2020-07-24 …
一个具有O型和M型血型的个体与一个具有B型和MN型血型的个体婚配,其子女可能的血型为()A.O型和M 2020-11-01 …
下列各项中读音错误的一项是:()A.撩拨liáo靡费mí静谧mì趔趄lièqièB.恶劣liè棕榈l 2020-11-11 …
将下列字母重新排列组将下列字母重新排列组成单词,完成句子.1.Daveishis(u,n,c,o,i 2020-12-17 …
在平行四边形ABCD中,对角线AC,BD相交于点O,直线m过点O,交BC于点F.若点G,H分别是BO 2020-12-25 …