早教吧作业答案频道 -->化学-->
工业上由钛铁矿(主要成分是FeTiO3钛酸亚铁)制备TiCl4.流程如图所示:(1)FeTiO3中,Ti元素的化合价为.(2)往①中加入的物质A是.(3)②中的绿矾带有棕黄色,原因可能是含有
题目详情
工业上由钛铁矿(主要成分是FeTiO3钛酸亚铁)制备TiCl4.流程如图所示: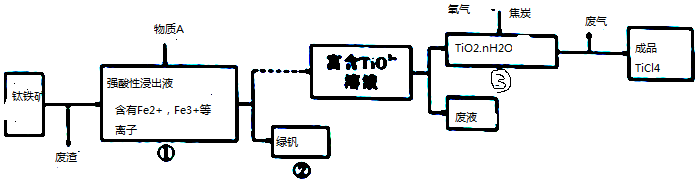
(1)FeTiO3中,Ti元素的化合价为___.
(2)往①中加入的物质A是___.
(3)②中的绿矾带有棕黄色,原因可能是含有___;设计实验证明Fe3+杂质离子的存在___;
(4)写出③中TiO2和过量焦炭、氯气在高温下反应的化学方程式:___.
(5)用金属Mg还原成品TiO4得到Mg、MgCl2和Ti的混合物,再真空蒸馏制备Ti. 依据下表,蒸馏温度略高于___℃即可.
(6)依据绿色化学理念.该制备流程中存在明显的不足之处是___.
(7)向含有Fe2+、Fe3+溶液加入适量KOH和油脂,在高速撞拌下得到磁流体材料KxFeO2.
①若x=l.请写出在酸性条件下KxFeO2溶液与足量KI溶液反应的离子方程式:___.
②磁流体材料KxFeO2在组成上可理解为aK2O•bFeO•cFe2O3,若x=1.3,则b:c=___.

(1)FeTiO3中,Ti元素的化合价为___.
(2)往①中加入的物质A是___.
(3)②中的绿矾带有棕黄色,原因可能是含有___;设计实验证明Fe3+杂质离子的存在___;
(4)写出③中TiO2和过量焦炭、氯气在高温下反应的化学方程式:___.
(5)用金属Mg还原成品TiO4得到Mg、MgCl2和Ti的混合物,再真空蒸馏制备Ti. 依据下表,蒸馏温度略高于___℃即可.
| Mg | MgCl2 | Ti | |
| 熔点/℃ | 648.0 | 714 | 1667 |
| 沸点/℃ | 1090 | 1412 | 3287 |
(7)向含有Fe2+、Fe3+溶液加入适量KOH和油脂,在高速撞拌下得到磁流体材料KxFeO2.
①若x=l.请写出在酸性条件下KxFeO2溶液与足量KI溶液反应的离子方程式:___.
②磁流体材料KxFeO2在组成上可理解为aK2O•bFeO•cFe2O3,若x=1.3,则b:c=___.
▼优质解答
答案和解析
钛铁矿加入酸酸浸,强酸性溶液中含有Fe3+、Fe2+等离子,向溶液中加入A能得到绿矾,说明A和Fe3+反应生成Fe2+,则A物质应该具有还原性且不能引进新的杂质,则A为Fe;溶液中含有TiO2+,③中TiO2和过量焦炭、氯气在高温下反应生成TiCl4,同时生成CO,该反应的化学方程式TiO2+2C+Cl2
TiCl4+2CO;
(1)FeTiO3中,O、Fe元素化合价分别为-2、+2价,根据化合物中各元素化合价的代数和为0确定Ti元素的化合价为0-(-2)×3-(+2)=+4,
故答案为:+4;
(2)往①中加入的物质A能还原铁离子且不能引进新的杂质,则A为Fe,故答案为:Fe;
(3)②中的绿矾带有棕黄色,铁离子呈黄色,所以溶液中可能含有铁离子;Fe3+能和KSCN溶液反应生成络合物而使溶液呈血红色,其检验方法为:取样,溶于水,向溶液中加入KSCN溶液,如果溶液变为血红色,证明含有Fe3+,
故答案为:Fe3+;取样,溶于水,向溶液中加入KSCN溶液,如果溶液变为血红色,证明含有Fe3+;
(4)TiO2和过量焦炭、氯气在高温下反应生成TiCl4,同时生成CO,反应方程式为TiO2+2C+Cl2
TiCl4+2CO,
故答案为:TiO2+2C+Cl2
TiCl4+2CO;
(5)用金属Mg还原成品TiO4得到Mg、MgCl2和Ti的混合物,再真空蒸馏制备Ti,蒸馏温度应该高于Mg、MgCl2的沸点,使Mg、MgCl2都转化为蒸气而除去,所以温度高于1412℃,
故答案为:1412;
(6)依据绿色化学理念,废物要综合利用,该流程图中三废没有处理,
故答案为:三废没有处理;
(7)向含有Fe2+、Fe3+溶液加入适量KOH和油脂,在高速撞拌下得到磁流体材料KxFeO2.
①若x=l,在酸性条件下KFeO2溶液与足量KI溶液反应生成I2、Fe 2+和水,Fe元素化合价由+3价变为+2价、I元素化合价由-1价变为0价,转移电子数为2,根据转移电子守恒配平方程式为8H++2FeO2-+2I-=2Fe2++I2+4H2O,
故答案为:8H++2FeO2-+2I-=2Fe2++I2+4H2O;
②磁流体材料KxFeO2在组成上可理解为aK2O•bFeO•cFe2O3,若x=1.3,根据K原子个数相等得
K2O•bFeO•cFe2O3,
根据Fe、O原子个数相等得
解得
,
则b:c=0.3:0.35=6:7,
故答案为:6:7.
| ||
(1)FeTiO3中,O、Fe元素化合价分别为-2、+2价,根据化合物中各元素化合价的代数和为0确定Ti元素的化合价为0-(-2)×3-(+2)=+4,
故答案为:+4;
(2)往①中加入的物质A能还原铁离子且不能引进新的杂质,则A为Fe,故答案为:Fe;
(3)②中的绿矾带有棕黄色,铁离子呈黄色,所以溶液中可能含有铁离子;Fe3+能和KSCN溶液反应生成络合物而使溶液呈血红色,其检验方法为:取样,溶于水,向溶液中加入KSCN溶液,如果溶液变为血红色,证明含有Fe3+,
故答案为:Fe3+;取样,溶于水,向溶液中加入KSCN溶液,如果溶液变为血红色,证明含有Fe3+;
(4)TiO2和过量焦炭、氯气在高温下反应生成TiCl4,同时生成CO,反应方程式为TiO2+2C+Cl2
| ||
故答案为:TiO2+2C+Cl2
| ||
(5)用金属Mg还原成品TiO4得到Mg、MgCl2和Ti的混合物,再真空蒸馏制备Ti,蒸馏温度应该高于Mg、MgCl2的沸点,使Mg、MgCl2都转化为蒸气而除去,所以温度高于1412℃,
故答案为:1412;
(6)依据绿色化学理念,废物要综合利用,该流程图中三废没有处理,
故答案为:三废没有处理;
(7)向含有Fe2+、Fe3+溶液加入适量KOH和油脂,在高速撞拌下得到磁流体材料KxFeO2.
①若x=l,在酸性条件下KFeO2溶液与足量KI溶液反应生成I2、Fe 2+和水,Fe元素化合价由+3价变为+2价、I元素化合价由-1价变为0价,转移电子数为2,根据转移电子守恒配平方程式为8H++2FeO2-+2I-=2Fe2++I2+4H2O,
故答案为:8H++2FeO2-+2I-=2Fe2++I2+4H2O;
②磁流体材料KxFeO2在组成上可理解为aK2O•bFeO•cFe2O3,若x=1.3,根据K原子个数相等得
| 1.3 |
| 2 |
根据Fe、O原子个数相等得
|
解得
|
则b:c=0.3:0.35=6:7,
故答案为:6:7.
看了工业上由钛铁矿(主要成分是Fe...的网友还看了以下:
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L 2020-04-08 …
AA、B、C、D、E、F六种短周期元素,原子序数依次增大.A、E同主族,且E元素原子的核外电子数是 2020-04-08 …
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L 2020-04-08 …
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L 2020-04-08 …
操作风险的成因主要包括( )。 A.人员因素B.内部流程 C.系统缺陷 D.外部因素 E.其他 2020-06-27 …
(2012•昆明模拟)[化学--选修3:物质结构与性质]有A、B、C、D、E五种短周期主族元素,它 2020-07-13 …
现有A、B、C、D、E、F六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,A、E同主族 2020-07-20 …
有位于周期表前四周期的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B是地壳中含量最多 2020-12-28 …
已知A、B、C、D、E、F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无 2021-01-05 …
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E 2021-01-05 …