早教吧作业答案频道 -->化学-->
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:(1)绿矾受热分解后,铁元素的化合价在分解前后是否发生了变化(填“是”或“否”),其理由是.(2)
题目详情
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
(1)绿矾受热分解后,铁元素的化合价在分解前后是否发生了变化___(填“是”或“否”),其理由是___.
(2)在FeO、Fe2O3、Fe3O4三种化合物中,与等质量Fe元素相结合的氧元素的质量比是___.
(3)将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL.则原硫酸的物质的量浓度是多少?
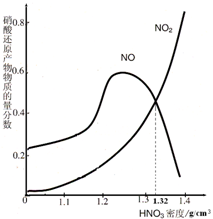
(4)由图示可知,m mol铁与过量的硝酸(ρ=1.32g/cm3)反应,反应放出n L气体(体积在标准状况下测定),其还原产物主要是___;此时溶液中Fe元素的存在形式是___,n 的值是多少?

(1)绿矾受热分解后,铁元素的化合价在分解前后是否发生了变化___(填“是”或“否”),其理由是___.
(2)在FeO、Fe2O3、Fe3O4三种化合物中,与等质量Fe元素相结合的氧元素的质量比是___.
(3)将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL.则原硫酸的物质的量浓度是多少?
(4)由图示可知,m mol铁与过量的硝酸(ρ=1.32g/cm3)反应,反应放出n L气体(体积在标准状况下测定),其还原产物主要是___;此时溶液中Fe元素的存在形式是___,n 的值是多少?
▼优质解答
答案和解析
(1)绿矾( FeSO4•7H2O )中硫的化合价为+6价,反应生成了二氧化硫,化合价降低了,根据氧化还原反应的特征可知,一定有元素的化合价升高,所以可以判断有铁元素的化合价在反应过程中升高了,
故答案为:是; 绿矾分解产物中有SO2,硫元素化合价降低,必有元素化合价升高;
(2)根据最小公倍数法求得:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,由题意可知,与等质量铁元素相结合的氧元素的质量比,就是氧原子的个数比,即为6:9:8,故答案为:6:9:8;
(3)Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知:n(NaOH)=2n(Na2SO4)=0.15L×4mol/L=0.6mol,故n(Na2SO4)=0.3mol,由硫酸根守恒可知n(H2SO4)=n(Na2SO4)=0.3mol,则c(H2SO4)=
=2 mol•L-1,故答案为:2 mol•L-1;
(4)依据图象可知,密度为1.32g/cm3的硝酸溶液与铁反应生成的还原产物NO2、NO的质量分数大约各占50%,硝酸过量生成铁离子,设生成气体物质的量为nmol,则二氧化氮和一氧化氮各占0.5n,依据得失电子守恒规律得:m×3=0.5×n×1+0.5×n×3,解得n=1.5mmol,标况下的体积为:1.5mmol×22.4L/mol=33.6mL,故答案为:NO2、NO;Fe3+;33.6m(L).
故答案为:是; 绿矾分解产物中有SO2,硫元素化合价降低,必有元素化合价升高;
(2)根据最小公倍数法求得:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,由题意可知,与等质量铁元素相结合的氧元素的质量比,就是氧原子的个数比,即为6:9:8,故答案为:6:9:8;
(3)Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知:n(NaOH)=2n(Na2SO4)=0.15L×4mol/L=0.6mol,故n(Na2SO4)=0.3mol,由硫酸根守恒可知n(H2SO4)=n(Na2SO4)=0.3mol,则c(H2SO4)=
| 0.3mol |
| 0.15L |
(4)依据图象可知,密度为1.32g/cm3的硝酸溶液与铁反应生成的还原产物NO2、NO的质量分数大约各占50%,硝酸过量生成铁离子,设生成气体物质的量为nmol,则二氧化氮和一氧化氮各占0.5n,依据得失电子守恒规律得:m×3=0.5×n×1+0.5×n×3,解得n=1.5mmol,标况下的体积为:1.5mmol×22.4L/mol=33.6mL,故答案为:NO2、NO;Fe3+;33.6m(L).
看了绿矾受热分解后的产物为不含硫元...的网友还看了以下:
速回一件上衣,经过涨价20%后又降价20%,则这件上衣最后的价格比原价______(上升或降价)了 2020-04-05 …
知道折后价和折扣点,如何计算出原价比如:折后价856,折扣点:0.3折,原价是多少呢?还有知道原价 2020-04-27 …
1,华联超市两次降低电磁炉的售价,第一次比原价降代了20%,降价后每台电磁炉卖380元,第二次又比 2020-05-16 …
在括号里填空...聪明的人来帮帮我1.3÷()=5分之1=24÷()=()%.2.12米减少它的4 2020-06-07 …
(预初数学题)某股票开盘后一小时上涨了开盘价的三个百分点,两个小时后回落了开盘价的两点五个百分点, 2020-06-25 …
看到这段话,我很怀疑.哪位高人指教下?送股之后,股价都回缩水阿.国内上市公司的分红一般都是很少的.如 2020-11-06 …
你还记得我吗,你回答过我的问题(1)某种商品先涨价25%后降价25%,现价是原价的百分之几?(2)某 2020-11-10 …
1.某种商品先涨价20%后降价20%,现价是原价的百分之几?2.某种商品先降价20%后涨价20%,现 2020-11-10 …
兄弟3人在外地工作,国庆节那天,他们同时回家,3人商量后汇价探望父母的时间是:大哥每8天回家一次,二 2020-11-14 …
随着各地对房地产市场调控的深入,近来某市房价持续回落,某楼盘原价为每平方米12000元,第一次降价后 2020-11-28 …