早教吧作业答案频道 -->化学-->
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验:(1)小组
题目详情
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件,该小组同学为探究中毒原因进行了如下实验:
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性,实验如下:
Ⅰ、用pH试纸检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7;
Ⅱ、取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅲ、另取10mL漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色;
Ⅳ、再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色.
①漂白液pH大于7的原因是(用离子方程式表示)___;
②由实验Ⅱ、Ⅳ得出ClO-具有氧化性与溶液酸碱性的关系是___;
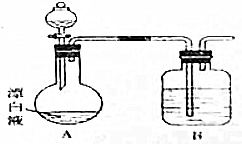
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成,用如图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2,装置B中盛放的药品及作用是___.

(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性,实验如下:
Ⅰ、用pH试纸检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7;
Ⅱ、取10mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸.
Ⅲ、另取10mL漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色;
Ⅳ、再取10mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色.
①漂白液pH大于7的原因是(用离子方程式表示)___;
②由实验Ⅱ、Ⅳ得出ClO-具有氧化性与溶液酸碱性的关系是___;
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成,用如图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2,装置B中盛放的药品及作用是___.
▼优质解答
答案和解析
(1)①NaClO为强碱弱酸盐,水解显碱性,水解离子反应为ClO-+H2O⇌HClO+OH-,故答案为:ClO-+H2O⇌HClO+OH-;
②Ⅱ中由白色沉淀生成,经检验白色沉淀不溶于盐酸,可知白色沉淀为BaSO4,发生氧化还原反应;
Ⅳ中加入少量稀硫酸酸化后,溶液红色立即变为无色,生成HClO,氧化性增强,
由上述两个实验对比可知,加入酸,反应速率加快,则ClO-的氧化性随氢离子浓度增大而增大,
故答案为:ClO-的氧化性随氢离子浓度增大而增大;
(2)漂白液在酸性溶液中有Cl2生成,则分液漏斗中为酸,B中盛放NaOH溶液,其作用为吸收氯气、防止污染空气,故答案为:NaOH溶液、吸收氯气.
②Ⅱ中由白色沉淀生成,经检验白色沉淀不溶于盐酸,可知白色沉淀为BaSO4,发生氧化还原反应;
Ⅳ中加入少量稀硫酸酸化后,溶液红色立即变为无色,生成HClO,氧化性增强,
由上述两个实验对比可知,加入酸,反应速率加快,则ClO-的氧化性随氢离子浓度增大而增大,
故答案为:ClO-的氧化性随氢离子浓度增大而增大;
(2)漂白液在酸性溶液中有Cl2生成,则分液漏斗中为酸,B中盛放NaOH溶液,其作用为吸收氯气、防止污染空气,故答案为:NaOH溶液、吸收氯气.
看了实验小组同学看到一则报道:某造...的网友还看了以下:
实验室中配制一种混合溶液,要使溶液中C(K+)=C(Cl-)=C(Na+)/2=C(SO42-),求 2020-03-30 …
下列各组离子在指定溶液中一定能大量共存的是()A.能使紫色石蕊试剂变红的溶液中:NO3-、I-、B 2020-05-13 …
不好意思,我只有41分了.都给你了哈.某一元弱酸HA及其盐NaA组成的缓冲溶液,pH=5.50.酸 2020-06-12 …
在下列溶液中,离子一定能大量共存的 A.强碱溶液:K+,Al3+,Cl-,硫酸根离子 B.在下列溶 2020-06-27 …
已知HkSO4电离方程式是:HkSO4=H++HSO4-,HSO4-⇌H++SO4k-,又知0.5 2020-07-09 …
头孢曲松钠皮试液怎么稀释配制了?头孢曲松钠1.0g怎么稀释配制皮试液的了? 2020-07-21 …
下列指定溶液中一定能大量共存的离子组是()A.pH=1的溶液中:NH4+、Na+、Fe3+、SO4 2020-07-22 …
某温度下,水的离子积常数K=10^-12,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合, 2020-07-25 …
已知H2A是二元弱酸,下列关系一定正确的是A:在0.1mol/LKHA溶液中,c(K+)+c(H2 2020-07-25 …
为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG═lgc(H+)/c(OH-).已知 2020-12-06 …